

本系列推文将聚焦PROTAC化合物的理化特性挑战,探讨如何通过晶型筛选、盐型/共晶优化、处方及制剂开发等策略改善其溶解性、稳定性、生物利用度等性质。期待为PROTAC化合物研发过程中遇到的问题提供解决思路。
内容导览
引言
临床前处方研究思路
临床前处方开发方案
3.1 减小粒径
3.2调节处方体系pH
3.3 复合物增溶
3.4 无定型固体分散体
3.5 脂质处方和自乳化体系
临床前处方评估
4.1 理化稳定性
4.2 体外溶出
4.3 动物PK
案例分享
结语
1
引言
新药的制剂开发优先以口服制剂为主,就目前研发阶段的PROTAC药物制剂以片剂为主,但PROTACs通常具有较差的类药性,其较大的分子量和高极性表面积导致其膜渗透性差、口服生物利用度低,往往不符合Lipinski五规则,且大多数PROTAC在BCS分类系统中被归类为IIb类或IV类。这些不利的理化性质和体内众多的生理屏障限制了其临床转化。为提高PROTAC分子的口服生物利用度,一是从化合物分子设计的角度尽可能的降低分子量,分子确定的情况下则需要从药物制剂的方向考虑生物利用度的提升方案。
本文为系列第二篇,在晶型盐型研究的基础上,将聚焦PROTAC化合物的临床前处方研究,探讨如何通过处方研究改善其溶解性、渗透性和成药性。
2
临床前处方研究思路
PROTAC化合物的临床前处方开发主要致力于解决其口服生物利用度低的问题,尤其是低溶解性和较差的膜渗透性。在早期研究阶段,需要在有限的周期内快速、准确评估化合物的性质。基于此,临床前的处方开发需要制定相适应的策略,克服化合物自身的理化性质缺陷,以实现更理想的暴露量和安全性,尽可能避免因吸收问题导致的研发失败。常用的策略包括:加入助溶剂或增溶剂以提高药物溶解度、将药物纳米化以提高溶解度和靶向蓄积、利用高分子聚合物载药系统、或借助脂质/自乳化体系实现有效释放。
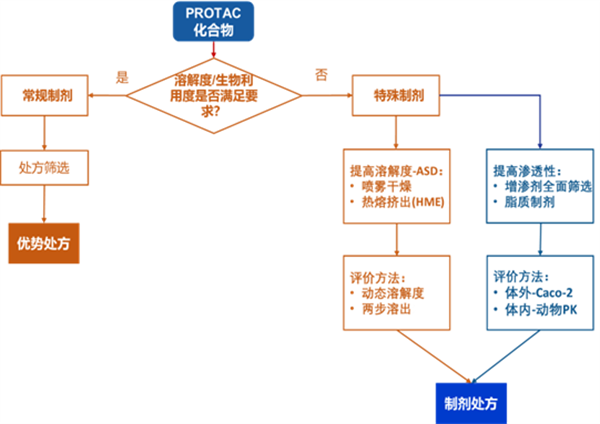
Fig. 1 PROTAC化合物研究思路
3
临床前处方开发方案
临床前处方研究方案,可对溶液以及混悬液处方进行简单的溶媒筛选,也可以从提高原料药的溶解度、生物利用度的角度采取特殊的制剂手段。
3.1 减小粒径
原料药的粒径大小会影响其溶出的速率和生物利用度,可以通过微粉化或纳米研磨获得比较高的比表面积,进而增加溶解速率。给药的混悬液处方中可以添加助悬剂、稳定剂和表面活性剂维持颗粒的稳定性。特别地,纳米晶技术还可通过吸附作用促进在胃肠道黏膜的滞留和吸收。尽管减小粒径在技术上相对直接和简单,对于PROTAC这类复杂分子而言,也仍然存在稳定性和工艺放大的潜在问题,需要综合考量制剂策略。
3.2 调节处方体系pH
处方的pH调节是改善化合物溶解度有效策略之一。该方法基于化合物的pKa和pH溶解度,通过调节体系pH以促进化合物的电离从而增强其溶解性。一般来说,弱酸在pH值高于其酸性pKa时溶解度增加,弱碱在pH值低于其碱性pKa时溶解度增加。为减少对机体的刺激性,pH的调节范围需结合具体剂型予以控制,一般建议将pH维持在3至9之间。
另外,形成原位盐(in-situ salt)也是改善其溶解度的一种方式,向游离态的处方体系中添加适量的酸性或碱性反离子,使其在制剂过程中直接成盐。需要注意的是,处方中所形成的原位盐仍应通过XRPD等表征手段进行充分的鉴定,并确认其在处方使用的时间范围内的物理/化学稳定性。
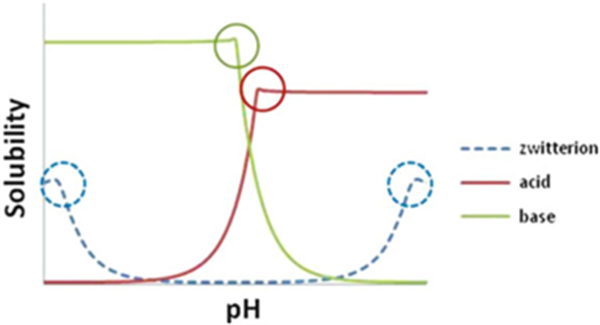
Fig. 2 pH溶解度曲线
3.3 复合物增溶
在制剂处方中,助溶剂和增溶剂是改善难溶性药物溶解行为的常用功能性辅料。
助溶剂(如PEG400、丙二醇、乙醇、DMSO等):可通过改变溶剂极性提高化合物溶解度。助溶剂的选择需要充分考虑其毒理学特性,特别是对于高剂量和长周期的毒理试验。
增溶剂:处方中通常还添加表面活性剂以改善溶解度,由于表面活性剂种类繁多,有阴离子型、阳离子型和非离子型表面活性剂,需要结合化合物自身的性质选择。
环糊精(如羟丙基β环糊HP-β-CD和磺丁基-β-环糊精 SBE-β-CD):可通过包合作用与药物形成复合物,能有效地增加药物在水中的溶解度和溶解速度,还能减少药物的不良气味或苦味,降低药物的刺激性和毒副作用,增加药物的稳定性和生物利用度。
处方的筛选一般从简单到复杂,首先从单一的增溶性组分开始筛选,在此基础上将助溶剂、表面活性剂、环糊精及pH调节策略等进行系统联用,以优化整体溶解性能。
3.4 无定型固体分散体
无定型固体分散体(ASD)是改善难溶性药物溶解度的最常用技术之一。通过在溶液中产生和维持药物的过饱和状态,抑制沉淀析出,可显著提高其溶解度和体内吸收。
ASD的制备方法主要有喷雾干燥、热熔挤出、冷冻干燥以及研磨等。其开发过程中的关键环节是聚合物载体的筛选,以及药物与聚合物的比例的优化。常用的聚合物载体包括纤维素类聚合物(如醋酸羟丙甲纤维素琥珀酸酯(HPMCAS)、羟丙甲纤维素邻苯二甲酸(HPMCP)、羟丙基甲基纤维素(HPMC)、聚乙烯吡咯烷酮聚合物(PVP)及其与醋酸乙烯酯的共聚物(PVP-VA64)、丙烯酸树脂类(Eudragit),以及较为新型的载体Soluplus等。此外,还可联用表面活性剂以及增渗剂进一步增溶增渗,但需注意表面活性剂的引入可能会在一定程度上降低固体分散体体系的物理稳定性。
无定型作为一种高能态,凭借其分子无序排列可显著提高药物的表观溶解度,进而提升生物利用度。然而,这种亚稳态也伴随着重结晶和物理化学不稳定的风险,因此需重点关注和控制样品存储条件来降低其重结晶的可能性。
3.5 脂质处方和自乳化体系
以脂质为基础的处方对于高Log P (>4)的PROTAC化合物可能会有良好的生物利用度改善效果,这类处方包括简单的油性处方、乳剂、微乳、自乳化给药体系(SEDDS)等。化合物需要在相应的脂质基质中具有足够的溶解度,同时所用辅料满足安全性和耐受性的要求。脂质基质通常为油脂、表面活性剂、共溶剂的多元混合物,处方在进入体内与胃肠道液接触后发生自乳化,形成纳米或微米级别的胶束或乳滴,从而促进化合物的吸收。脂质为基础的处方筛选首先需要对化合物在油相、表面活性剂和助表面活性剂中的溶解度进行筛选,再基于单一组分中的溶解度和耐受量进行辅料的选择和组合,进一步评估其溶解度、相容性和稳定性。尽管这种方式存在巨大的增溶潜力,但其稳定性和释放行为仍高度依赖于油相、表面活性剂和助表面活性剂的选择,优化难度较大。
4
临床前处方评估
筛选的处方需进一步评估,包括理化稳定性、体外溶解度等,以确定合适的储存条件、使用周期。此外,体外的模拟试验可帮助了解处方在进入体内后的溶解、溶出、析出情况以及纯度、粒径等变化情况。在体外评估的基础上,进一步开展动物PK,以评估生物利用度。
4.1理化稳定性
处方的物理化学稳定性通常在预期的存储条件和使用周期内进行评估,以便确认实际的使用条件和可能存在的风险。对于溶液处方,需要观察样品是否有析出,并同时确认pH值、纯度和浓度变化;对于混悬液处方,需确认样品在储存条件下的均一性(Homogeneity),混悬液中颗粒的粒径分布、固体形式变化情况也需要持续关注。
4.2体外溶出
为了解处方在进入生物体内的变化,可通过一系列体外的溶出试验进行模拟评估。
对于注射的处方,考察处方在pH 7.4的缓冲液或模拟血浆中样品的状态,如出现沉淀则提示该处方在进入体内后也存在析出的风险。对于口服的处方,通常评估的是其在胃肠道条件下的溶出情况和固态形式的变化,故相应的溶出试验也是在模拟胃液(SGF)和模拟禁食肠液(FaSSIF)中进行两阶段的考察,溶出样品需要确认是否有析出,若有不溶或者析出需确认固体的属性,并确认体系的pH值和浓度、纯度情况。体外的评估可为处方的选择优化和动物试验的开展提供参考,但最终是否能满足临床前试验的使用需求,还需通过动物试验加以验证。
4.3 动物PK
1)动物模型
临床前研究常用的动物有小鼠、大鼠、兔、狗、猴等,不同种属的动物对于药物及辅料的耐受性存在差异,具体的耐受程度也与给药的剂型和给药途径相关。从安全性的角度,处方中辅料种类和用量的确定均需在试验对象的耐受范围以内,以避免对试验结果的准确性造成影响。
2)给药途径
不同的给药途径直接影响药物在体内的吸收、分布、代谢和排泄过程,需关注不同给药途径的差异,常见的有口服(PO)和静脉给药(IV),其他肠胃外(parenteral)给药方式还有腹腔注射(IP)、肌肉注射(IM)、吸入制剂(IT)、皮下注射(SC或SQ)等。
3)给药剂量和周期
动物试验给药的剂量和周期取决于动物试验的研究目的,毒理试验中会涉及到多剂量的重复给药和剂量递增的研究,较高的给药剂量对处方中药物的溶解度和在体内的生物利用度提出了挑战,而较长的给药周期则对处方的稳定性有一定要求。
5
案例分享
案例一:
化合物A临床前动物实验处方开发
项目背景
Mw:~1100 Da
理化性质:无定型游离态,碱性pKa ~5.8, Log P ~5.5
挑战:低溶解度、低渗透性、Efflux ratio高
研究方案
本案例需提高化合物的溶解度和渗透性,在体内达到足够的暴露量。同步开展溶液/混悬液处方的筛选和固体分散体的筛选,对比体外增溶效果和体内PK表现,评估合适的制剂手段。
溶媒筛选:利用化合物的碱性pKa,通过调节处方pH,形成in-situ salt以提高溶解度;筛选表面活性剂、增溶剂、油相,选择合适的增溶增渗辅料组成脂质处方,提高溶解度和渗透性。
固体分散体:添加适量的表面活性剂,改善溶解度和渗透性。
研究结果
体外溶解度:
- 优选的脂质溶媒中,化合物溶解度可提高40倍,且处方稳定性佳,满足给药需求。
- 以PVP VA64为载体的固体分散体,在生物介质中有明显的增溶效果,溶解度提升50倍。
小鼠PK:
脂质处方和固体分散体混悬液在小鼠的PK吸收表现,在中等剂量下,脂质处方和固体分散体具有相当的体内吸收(AUC)。但提高剂量后,脂质处方的吸收优于固体分散体。
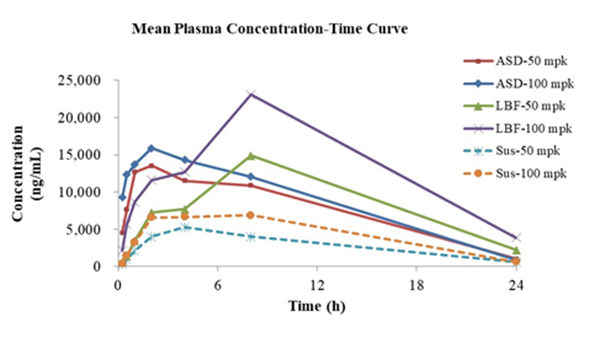
Fig. 3
总结:
从毒理试验长期给药来说,需考虑辅料在不同种属体内的耐受程度。本项目从溶解度、安全性等方面综合评估,选择固体分散体进行后续开发。
案例二:
化合物B临床前毒理试验处方的开发
项目背景
Mw:~850 Da
挑战:水溶性低、存在热稳定性风险;前期盐型研究,其成盐对于溶解度提升有局限
研究方案
本案例需提高化合物溶解度,开发100 mg/mL浓度的处方,支持临床前毒理研究。因热稳定风险对开发无定型分散体受限,调整为溶液或混悬液处方。
减小粒径:通过球磨法,将混悬液处方中API的粒径减小到纳米尺度给药;
处方筛选:增溶剂、助悬剂等辅料系统筛选,选择合适的助悬剂和表面活性剂。
研究结果
球磨的方法将晶型游离碱制备成均匀的纳米混悬液,粒径大小~400 nm。
与结晶态API及其常规混悬液相比,纳米混悬液在生物相关溶媒中表现出显著提高的溶解度和溶出速度,溶解度在SGF体系中提升近500倍。
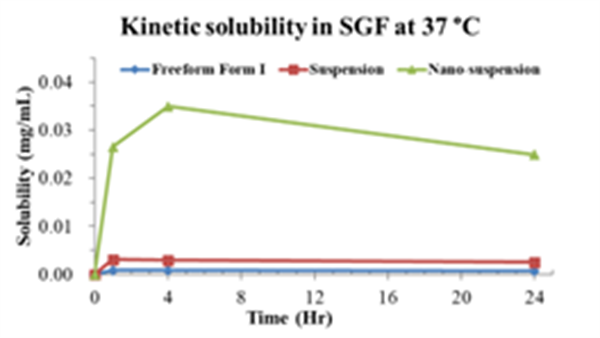
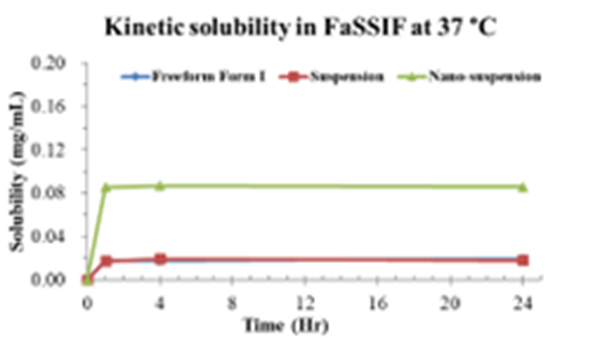
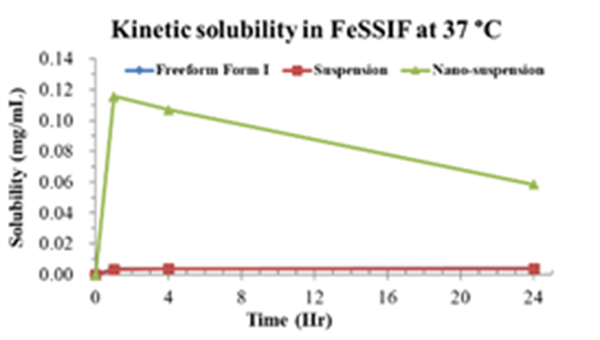
Fig. 4-6
不同生物溶媒下的动态溶解度
总结:
本项目开发的纳米混悬剂,稳定性佳,且能够满足当前的溶解度需求,供后续毒理研究。
6
结语
PROTAC技术本身具有巨大的治疗潜力,但其最终的临床成功在很大程度上取决于能否有效地将API有效递送。开发合适的临床前处方可以有效地衔接药物的处方前研究和动物实验,并为临床试验和进一步开发做好铺垫。面对新药化合物越来越多的溶解度、生物利用度和稳定性方面的挑战,晶云结合PROTAC化合物的理化性质以及前期晶型盐型筛选数据,采用相适应的制剂手段为PK和毒理学研究提供满足安全性和生物利用度需求的处方,使得化合物体现出理想的暴露量和耐受性,更有效和准确地收集药毒理数据,为药物进一步的临床试验的设计和制剂产品的开发提供支持。
参考文献
Syahputra, E. W., Lee, H., Cho, H., Park, H. J., Park, K. S., & Hwang, D. (2025). PROTAC Delivery Strategies for Overcoming Physicochemical Properties and Physiological Barriers in Targeted Protein Degradation. Pharmaceutics, 17(4), 501. https://doi.org/10.3390/pharmaceutics17040501
Edmondson, S. D., Yang, B., & Fallan, C. (2019). Proteolysis targeting chimeras (PROTACs) in 'beyond rule-of-five' chemical space: Recent progress and future challenges. Bioorganic & medicinal chemistry letters, 29(13), 1555–1564. https://doi.org/10.1016/j.bmcl.2019.04.030
Hofmann, N., Harms, M., & Mäder, K. (2024). ASDs of PROTACs: Spray-dried solid dispersions as enabling formulations. International journal of pharmaceutics, 650, 123725. https://doi.org/10.1016/j.ijpharm.2023.123725