

内容导览
1. 依维莫司简介
2. 依维莫司杂质晶型的定量/限度研究
3. 如何开展依维莫司杂质晶型的定量/限度研究
3.1 定量or限度?
3.2 方法验证
4. 小结
1
依维莫司简介
依维莫司(Everolimus),商品名飞尼妥,是一种哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂。它通过特异性阻断mTOR信号通路,从而抑制肿瘤细胞的生长和增殖。依维莫司最初由瑞士诺华公司研发,并于2009年在欧盟和美国上市,2013年在中国上市。正大天晴于2024年1月获得中国国家药品监督管理局批准仿制药生产,成为国内首仿+首家过评的企业。依维莫司也是我国药品专利纠纷早期解决机制(药品专利链接制度)实施以来,全国首个挑战专利成功的产品,使其(正大天晴)获得12个月市场独占期。
2
依维莫司杂质晶型的定量/限度研究
原研依维莫司片中原料药以无定形形式存在,无定形具有较高的吉布斯自由能,相对于晶态物质具有较高的溶解度。据专利报道,无定形依维莫司的溶解度比晶态依维莫司提高约25倍。然而,由于无定形大多处于亚稳态,其物理和化学稳定性是不可忽略的问题。专利中报道,无定形依维莫司在常用有机溶剂中进行打浆很容易得到晶态依维莫司(图1)。因此,原研通过制剂手段将依维莫司原料药做成无定形固体分散体(ASD),通过添加0.2%BHT(抗氧化剂)来改善无定形原料药的物理化学稳定性。然而,在制剂工艺、稳定性研究及储存过程中,无定形态的原料药仍存在一定的转晶风险。根据监管的要求,就需要针对依维莫司ASD及制剂中可能存在的晶态依维莫司开发相应的定量/限度分析方法,以监控和确认无定形是否稳定可控。
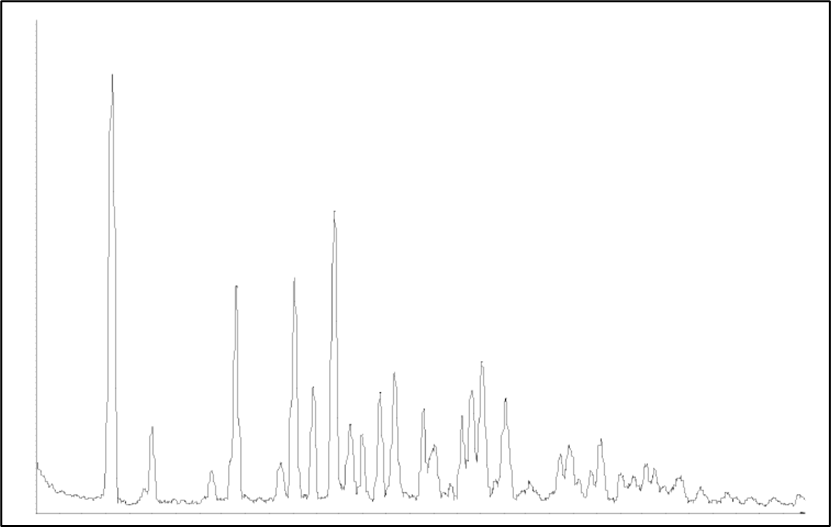
图1 晶态依维莫司XRPD图
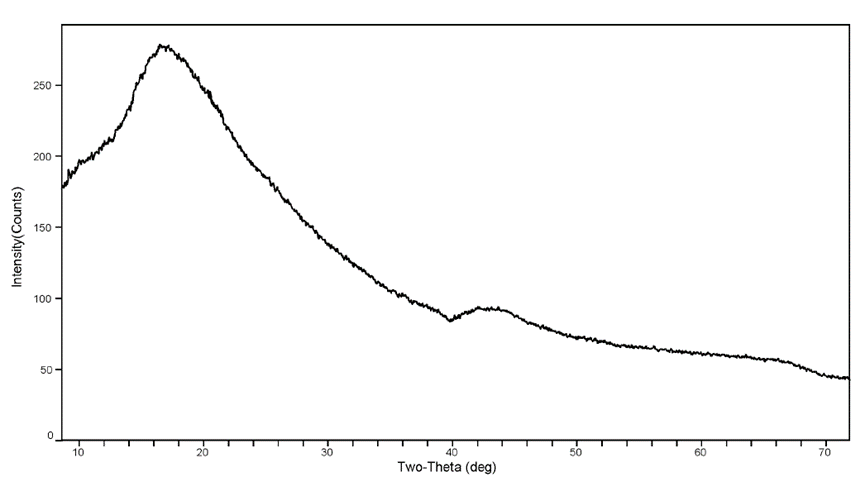
图2 无定形依维莫司XRPD图
3
如何开展依维莫司杂质晶型的定量/限度研究
3.1 定量or限度?
如杂质晶型的产生是可通过优化生产/制剂工艺等手段规避,或前期通过高灵敏度检测方法未检出杂质晶型,建议开发限度方法即可;如杂质晶型的产生不可避免,或已确认产品中晶型以混晶形式存在,则建议开发定量方法进行晶型质量控制。以依维莫司为例,对于制剂中API以无定形形式存在的品种(以ASD中间体的形式或者直接将无定形API用于制剂),就需要对制剂各个环节的晶型进行控制,确保原料药晶型处于未检出状态,从而保证终产品的溶解度和生物利用度能够满足临床需要。同样的,稳定性样品也需要定期监测其是否发生了转晶,以确保产品在货架期的稳定性。因此,对ASD、制剂均需开展杂质晶型的限度研究,在一些案例中,无定形原料药也要求开展对应的限度研究。
对于限度研究的检测限,建议结合工艺和稳定性过程中无定形转晶的情况、杂质晶型对产品溶出和生物利用度的影响进行考察。对于仿制药项目,也可检索原研及同类品种的研究情况以供参考。
3.2 方法验证
根据《药品晶型研究及晶型质量控制指导原则》,采用的晶型定量分析方法应符合《药品质量标准分析方法验证指导原则》的专属性、检测限和耐用性等内容相应要求。因此,我们对开发的依维莫司ASD和制剂中杂质晶型限度方法进行相应的方法学验证,确保各项验证内容均满足要求。
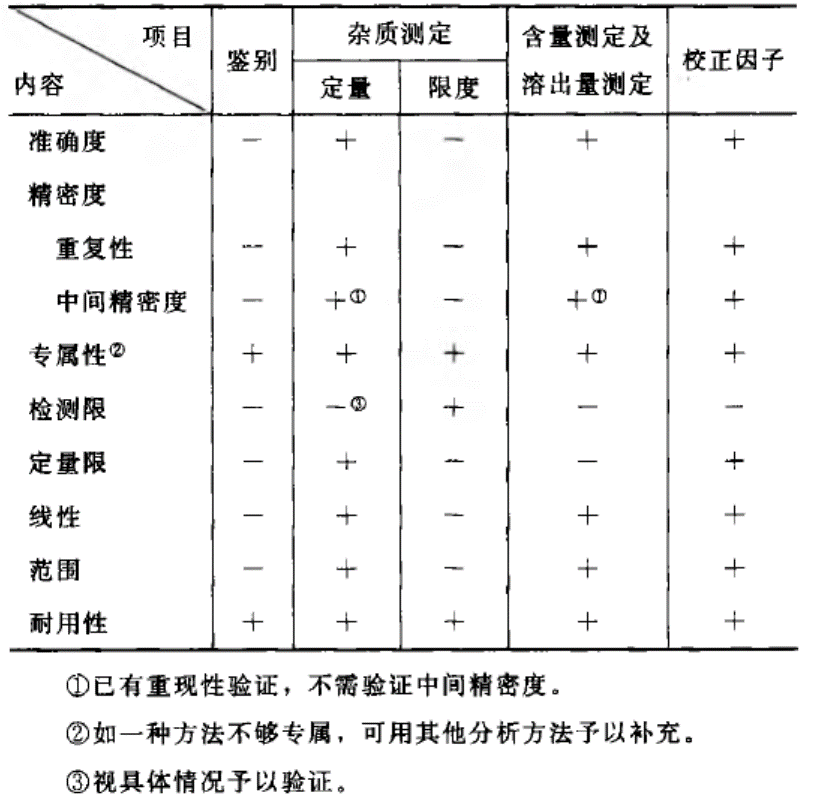
图3 《药品质量标准分析方法验证指导原则》中关于限度研究的验证项
4
小结
对于依维莫司而言,由于晶态与无定形依维莫司的溶解度差异较大,原研依维莫司片中API以无定形形式存在。而无定形大多处于亚稳态,在生产制造、制剂和储存过程中,有一定的转晶风险。因此对依维莫司原料药及制剂进行定量/限度研究是必需的。晶云药物已支持了很多ASD制剂品种的限度研究项目,积累了丰富的经验。
在药物晶型定性和定量分析方面,晶云药物具有丰富的开发经验,已为数百家客户完成超过300个品种的制剂中晶型定性研究,超80个晶型定量研究项目。晶云药物采用XRPD方法开展原料药和制剂中晶型定性、定量研究,除常规片剂、胶囊晶型定性定量分析外,还成功开展干混悬剂、软膏剂、贴剂、粉雾剂、喷雾剂、混悬剂等剂型的研究。面对日益严格的监管需求,晶云药物希望用更专业的技术、更有效的沟通,来支持广大客户不同阶段的定量研究相关需求!