

内容导览
1. 理化性质评估
2. 生物药剂学基准评估
2.1 DCS分类
2.2 临床前剂量数
2.3 增溶指导图
2.4 制剂决策树
3. PBPK建模
4. 结论和后续开发策略
在药物的早期研发阶段,我们通常对化合物的性质知之甚少。然而,开发者总是渴望通过有限的化合物尽快获取最关键的信息,以助力优选候选化合物和规划合适的开发策略。晶云引领的“首次正确三步走(Mol2Med™ First-Time-Right 3-Step Approach)”策略,旨在早期充分了解化合物性质和潜在开发风险,确保每一步决策准确无误,避免因早期策略不当而导致的临床失败和时间成本的浪费。
首次正确三步走的第一步,就是药物可开发性评价(Developability Assessment)。可开发性评价专注于处于开发早期先导优化阶段或候选阶段的化合物,利用制药界成熟的评价模型和计算机模拟手段,结合化合物的理化性质进行综合评估。评价结果可以指导化合物固态形式的选择、临床前处方以及制剂产品的开发策略,并识别潜在的开发风险。在药物研发的快节奏中,为确保首次即正确的决策,迅速准确地获取化合物的关键信息并做出正确的分析判断至关重要。晶云提供的可开发性评价服务,仅需500 mg的原料药和4周的研究时间,即可呈现以下关键信息:
♦
Key physicochemical properties of compound(s)
化合物的关键理化性质
♦
Biopharmaceutical benchmarking of compound(s)
生物药剂学基准评估
♦
Understanding of PK data and PBPK extrapolation
PK数据解读和PBPK模型外推
♦
Direct guidance and path for:
指导API固态形式选择,定制处方以加速临床研究
API solid form selection for GLP Tox and GMP
Achieving success in GLP Tox
Tailored formulation for speed to and through the clinic
药物可开发性评价的基本工作流程如下图所示,但实际的研究内容灵活机动,可以根据化合物当前阶段的开发需求和现有数据的丰富程度进行调整或聚焦。我们希望能在充分了解化合物开发背景的基础上,开展相适配的评估工作,以帮助正确的认识和规避可能的开发风险。
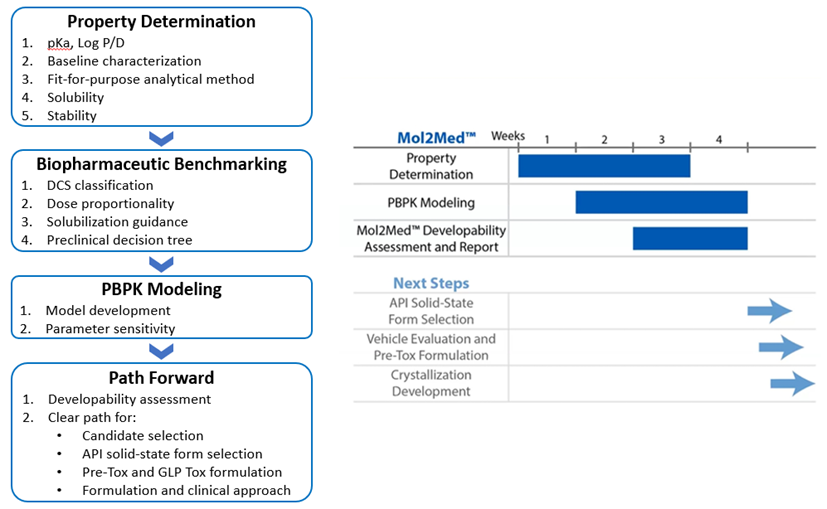
图1 可开发性评价工作流程
1
理化性质评估
(Property Determination)
在药物的可开发性评价中,关键的理化性质主要包括化合物的pKa、log D/P,渗透性以及溶解度,稳定性。具体来说:
♦
pKa、log D/P测试和基础的固态表征仅需少量样品支持,即可快速获得结果。
♦
对于化合物的渗透性,可以通过体外评估(如Caco-2、MDCK或PAMPA)作为参考,从而在此基础上预估化合物在人体的渗透性。
♦
在溶解度方面,可开发性评价中最为关注的是化合物在胃肠道环境中的溶解度,因此会收集模拟胃液和餐前、餐后模拟肠液中的溶解度数据。在早期研发阶段,原料药的数量有限且宝贵,通常是通过色谱柱分离和冷冻干燥的方式获得的。然而,这类方法得到的物料大多会是无定形或低结晶度的样品,其溶解度与低能量的结晶状态相比,可能会有数量级的差异。在可开发性评价中,无定形的溶解度数据不一定能准确反映化合物的性质和充分暴露潜在的开发风险。因此,建议在评估之前对现有的物料开展小规模的、快速的初步晶型筛选试验:
尽早识别化合物多晶型的风险,了解其多晶型现象是否复杂
从有限的试验中分离出固态性质可接受的晶型(无水晶型或水合物),用于进一步的数据收集,尤其是溶解度
如果候选化合物有成盐的潜力,建议同步开展小规模的成盐筛选,以得到性质较好的盐型与游离态对比可开发性,提前了解成盐的增溶潜力
♦
稳定性评估包括加速条件下晶型的短期固态稳定性,和化合物在强制降解条件下的短期溶液稳定性。快速的稳定性评估有助于预估后期化合物在储存过程中的稳定性风险,以及在体内胃肠道环境中的降解趋势。
2
生物药剂学基准评估
(Biopharmaceutical Benchmarking)
在基于体外收集的理化性质数据和化合物的目标给药剂量的基础上,即可对一个或多个候选化合物开展生物药剂学基准评估。不同的药物开发公司可能有各自独特的可开发性评价标准,晶云进行基准评估的标准和方法是通过整理制药界成功开发的化合物案例、数据以及相应的参考文献整合而出的,主要包括以下模块。
2.1 DCS分类(Developability Classification System)
DCS分类是在BCS分类(Biopharmaceutics Classification System, 生物药剂学分类系统)的基础上建立的可开发性分类系统,整合了口服吸收途径中的关键理化和生理性质,即溶解度和渗透性。但对原有的评价指标进行了优化,以更适用于药物早期开发阶段的策略指导和风险分析。
♦
考虑到小肠是大多数药物的主要吸收部位,DSC分类所参考的是化合物在模拟肠液中的溶解度和相应500 mL的肠液平均体积,以界定化合物的溶解度水平。
♦
在渗透性方面,DCS参考公认的高渗药物——美托洛尔的小肠渗透率1*10-4 cm/s,作为评价渗透性的标准。
♦
此外,对于常见的II类低溶解度高渗透性的药物,尽管初始状态下药物可能无法完全溶解于肠道中,但已溶解部分药物的快速吸收为进一步溶解提供了机会。若溶出的药物尚未达到最大的吸收剂量,则属于溶出速率限制吸收(IIa类),可以考虑通过加速溶出的方法改善吸收,例如减小粒径;若此时药物已经达到最大吸收剂量,则为溶解度限制吸收(IIb类),可以考虑采用提高溶解度的方法,如成盐或固体分散体、脂质体等制剂手段。
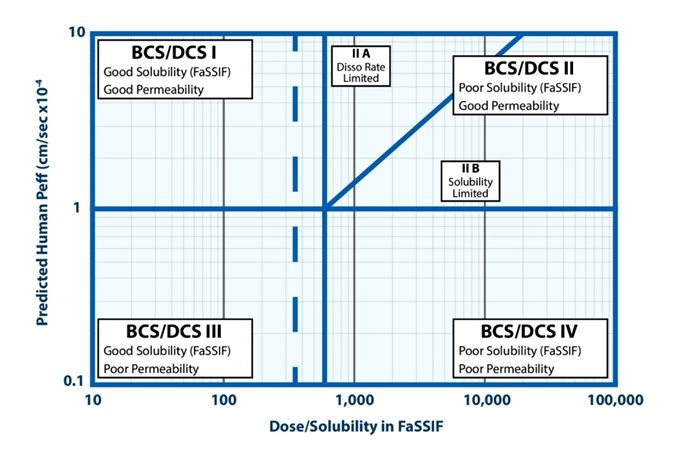
图2 DSC分类系统
2.2临床前剂量数(Preclinical Dose Number, PDo)
临床前的动物试验会涉及多物种和给药剂量,尤其需要较高剂量的毒理试验中,药物在动物体内的暴露量是否成剂量比例往往是研究者所关注的。默克公司通过分析和统计超过900组大鼠、狗和猴子体内试验数据,定义了临床前剂量数PDo和AUC-剂量比例DP,以用于预测药物在不同给药剂量下的潜在的吸收风险。
PDo的计算较为简单,仅需将药物剂量(mpk)除以化合物在FaSSIF中溶解度。而DP则是将所选剂量和基准剂量下AUC比值与对应剂量的比值进行归一化。从实际应用的角度来看,可将DP值分为下图中的3类:DP > 0.6表示体内表现良好,而DP ≤ 0.4则表示体内表现不理想。随着PDo的增加,DP > 0.6的研究百分比也在下降,表明化合物在体内的暴露量与剂量不成比例的风险就越大。然而,该分析相对保守,未考虑给药制剂对化合物可能的增溶效果和吸收改善。
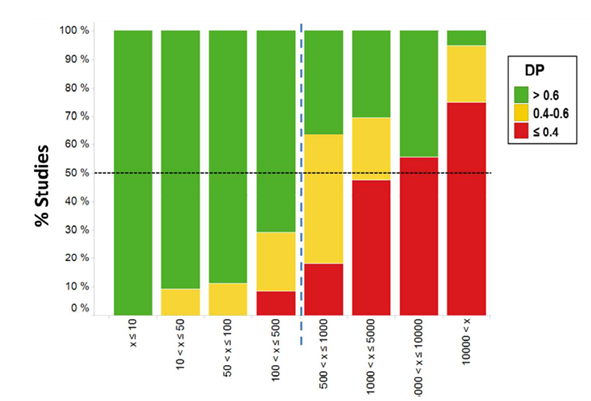
图3 不同PDo分级对应AUC-剂量比例分布情况
2.3 增溶指导图(Solubilization Guidance Map)
增溶指导图可以帮助预估结晶态的化合物在给定剂量下是否满足开发需求,指导制剂开发策略的选择。基于化合物的剂量、溶解度和Log P,可以在图中找到相应的位置。若落在在绿色区域,则表示开发结晶态样品是可满足需求的。若向红色区域靠近,则结晶态样品可能逐渐无法满足开发需求,可以考虑采用增溶手段如无定形固体分散体或其他制剂技术。
对于该模型的预测,也可以分别代入餐前、餐后模拟肠液的溶解度进行结果的对比,以评估餐后给药的增溶潜力。但需注意该模型未考虑体内代谢和实际的渗透性等影响因素。
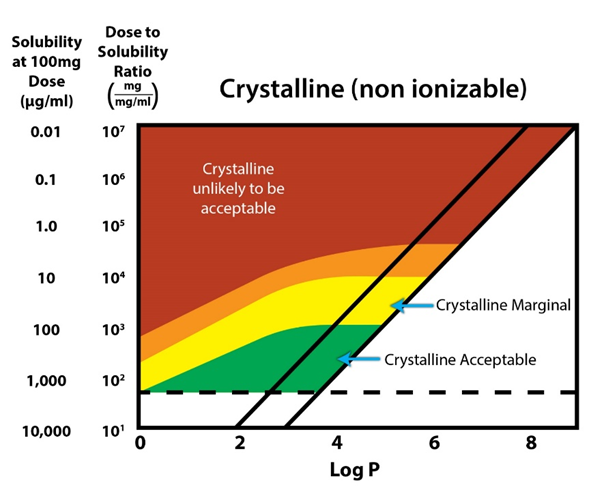
图4 增溶指导图
2.4 制剂决策树(Preclinical Decision Tree)
Janssen所使用的制剂决策树,同样也用于指导制剂策略的选择,其计算和分析也是基于化合物的剂量和溶解度。仅需基于不同条件下的溶解度分别计算剂量数(Do)值,代入决策树来判断传统制剂是否符合开发需求。若传统制剂不适用,则进一步评估餐后给药是否可以有效提高溶解度以满足给药需求,或需要进一步采用特殊的增溶制剂和手段。
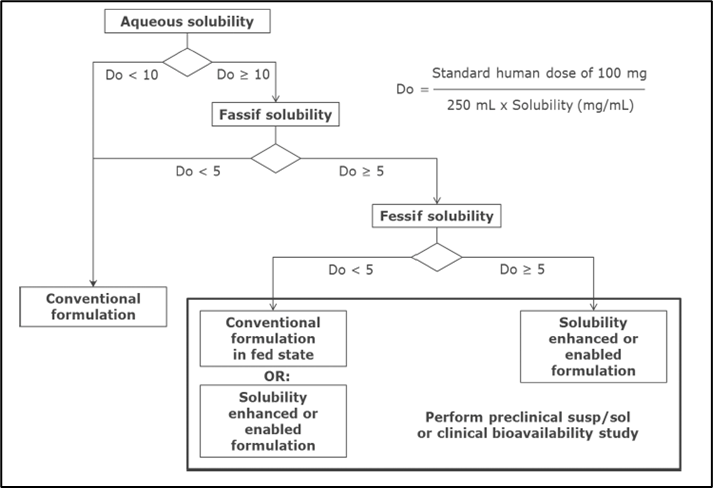
图5 制剂开发决策树
3
PBPK建模
(PBPK Modeling)
以上生物药剂学经典基准评估模型通常相对简单,有助于快速指导决策和分析风险,但这类模型未考虑化合物在体内实际吸收和代谢的情况,适用于早期化合物研究数据有限的情况。如果化合物已经有充足的动物PK数据,可以进一步利用计算机模拟软件GastroPlus®构建PBPK模型,以满足各类预测和模拟的需求。
PBPK模型虽然可基于简单的化合物结构构建,但随着输入的实测数据增多(如理化参数、溶解度、渗透性、DMPK数据等),模型的建立则更加合理可靠。在此基础上,模型可预测化合物在不同种属体内的吸收,甚至外推至人体模型,预测化合物在人体吸收、分布、代谢等情况。并可对化合物开展参数敏感性分析(Parameter Sensitivity Assessment),以鉴定影响化合物口服吸收的关键因素,特别是溶解度、粒径、剂量等参数,从而指导制剂处方的设计。此外,计算机模拟的结果也可以与生物药剂学基准评估的结果进行对比,以互相佐证结论是否一致。
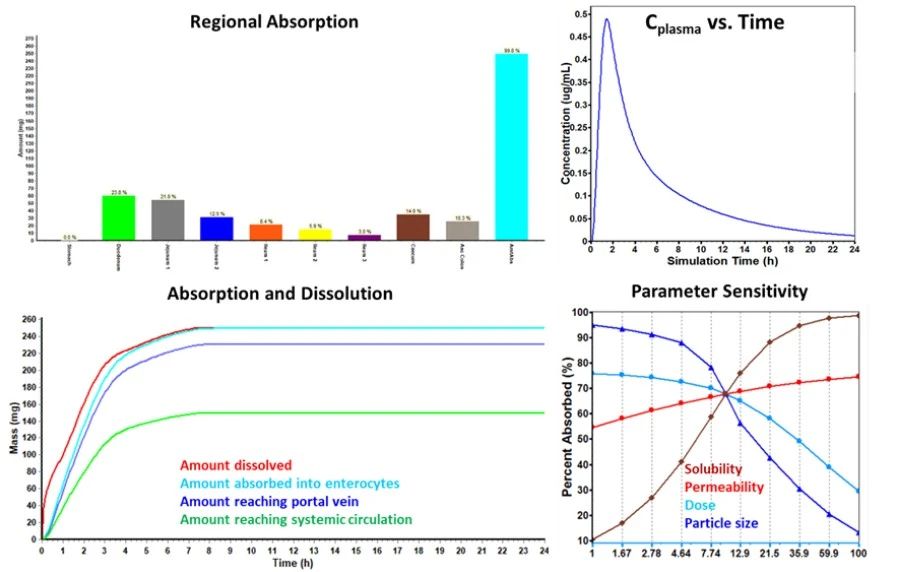
图6 GastroPlus®预测的典型输出结果
4
结论和后续开发策略
通过关键数据的收集、系统的分析和基准评估,可开发性评价可以输出以下关键的信息和建议,以帮助我们更好地理解化合物的特性,尽早识别和规避开发风险,并顺利衔接下一阶段的研究工作。
♦化合物的关键理化性质:了解原料药的多晶型情况,指导下一步的晶型筛选和选择,识别潜在的稳定性风险。
♦生物药剂学基准评估和PBPK建模预测:
识别影响口服吸收的关键参数
指导合理的固态形式选择(游离态vs. 盐,晶型vs. 无定形)
识别临床前试验中潜在的吸收风险,了解餐前/餐后给药的影响
指导制剂处方开发和优化(常规制剂vs. 增溶制剂vs. 粒径控制)
参考文献
[1]. Pudipeddi M, Serajuddin A T M. Trends in solubility of polymorphs [J]. Journal of pharmaceutical sciences, 2005, 94(5): 929-939.
[2]. Wuelfing W P, El Marrouni A, Lipert M P, et al. Dose number as a tool to guide lead optimization for orally bioavailable compounds in drug discovery [J]. Journal of Medicinal Chemistry, 2022, 65(3): 1685-1694.
[3]. Butler J M, Dressman J B. The developability classification system: application of biopharmaceutics concepts to formulation development [J]. Journal of pharmaceutical sciences, 2010, 99(12): 4940-4954.
[4]. Amidon G L, Lennernäs H, Shah V P, et al. A theoretical basis for a biopharmaceutic drug classification: the correlation of in vitro drug product dissolution and in vivo bioavailability [J]. Pharmaceutical research, 1995, 12: 413-420.
[5]. Oh D M, Curl R L, Amidon G L. Estimating the fraction dose absorbed from suspensions of poorly soluble compounds in humans: a mathematical model [J]. Pharmaceutical research, 1993, 10: 264-270.
[6]. Wuelfing W P, Daublain P, Kesisoglou F, et al. Preclinical dose number and its application in understanding drug absorption risk and formulation design for preclinical species [J]. Molecular Pharmaceutics, 2015, 12(4): 1031-1039.
[7]. Fridgeirsdottir G A, Harris R, Fischer P M, et al. Support tools in formulation development for poorly soluble drugs [J]. Journal of Pharmaceutical Sciences, 2016, 105(8): 2260-2269.
[8]. Van den Bergh A, Van Hemelryck S, Bevernage J, et al. Preclinical bioavailability strategy for decisions on clinical drug formulation development: an in depth analysis [J]. Molecular Pharmaceutics, 2018, 15(7): 2633-2645.