



本文献通过康奈非尼两组临床实验,探究了食物和质子泵抑制剂(PPI)对康奈非尼体内吸收的影响。同时,利用GastroPlus®建模来模拟禁食、饱食和PPI状态下的康奈非尼体内吸收情况。计算机模拟结果与临床研究数据进行对比,展现出了高度一致性,显示出计算机模拟在制剂开发方面的应用潜力。
原文链接
https://doi.org/10.1021/acs.molpharmaceut.3c00016
康奈非尼(Encorafenib)是一种口服小分子激酶抑制剂,对突变BRAF激酶具有强效的选择性抑制活性。目前已被FDA批准上市,联合贝美替尼用于治疗存在BRAF V600E或BRAF V600K突变的不可切除性或转移性黑色素瘤,以及联合西妥昔单抗用于治疗经治、携带BRAF V600E突变的转移性结直肠癌。
Figure 1. Structure of Encorafenib
食物可以通过多种机制改变药物的生物利用度,如延迟胃排空、改变胃肠道(GI) pH值和液体量、刺激胆汁分泌、增加内脏血流量、改变药物的管腔代谢,或与药物产生物理/化学相互作用。由于食物效应与多种影响药物溶解度与溶出的因素(包括所使用的处方或递送系统)相关,多数情况下,需要对食物效应相关的生物利用度进行研究,以了解食物对药物吸收的影响。另外,弱酸或弱碱化合物的溶解度和溶出也会因减酸剂(ARA,如组胺H2受体拮抗剂或质子泵抑制剂(PPI))导致的胃pH值升高而发生改变。ARA或食物伴随给药引起的生物利用度变化也会影响药效学终点,多见于弱碱药物。基于上述原因,评估药物间相互作用的风险对于确定康奈非尼的合理剂量至关重要。
PBPK(生理药代动力学)模型可以帮助处方科学家探索处方、生理学状态或人群等条件对药物系统性暴露的影响。通过参数敏感性分析,判断哪些参数在吸收过程中起到了关键作用。此外,如药物处方在临床阶段或批准上市后发生了变化,也可通过软件模型计算预测这些变化对药物疗效的影响。
本文献中,为研究食物和PPI对康奈非尼口服吸收的影响,研究人员设计开展了2组临床试验。试验1评估了高脂饮食对康奈非尼PK的影响。试验2评估了同时服用PPI时对康奈非尼PK的影响。本研究的重点关注在(1)口服康奈非尼以ASD形式向健康受试者给药后的临床数据;(2)计算机建模的口服吸收模型是否能够模拟康奈非尼的PK和生物药剂学特性。通过体内、体外和计算机模拟相结合的手段,帮助处方科学家更好地理解药物在人胃肠道中的溶解和吸收过程。
PBPK建模
本研究中使用了Simulations Plus, Inc.的PBPK建模平台GastroPlus 9.8。所有模拟结果均使用了试验1和2中健康受试者口服100 mg康奈非尼胶囊后,实测的康奈非尼的几何平均PK浓度进行评估,并对禁食、饱食和PPI状态进行了预测。建模平台的所有输入数据,包括化合物的理化性质、剂型特点及吸收、分布、代谢和排泄特性,如Table 1所示。
Table 1. PBPK Model Parameters

需要说明的是,建模过程中输入的溶解度数据为无定形药物在pH 6.8下的溶解度(为晶型溶解度的20倍)。在溶出方面,研究人员选择了Johnson模型,用于说明溶出中的粒径变化以及圆柱体颗粒的溶出情况。在饱食状态下,为了与观察到的PK数据保持一致,研究人员将胃传输时间调整为2.25 h,并将生理学参数调整为饱食状态(默认设置)。为模拟PPI条件,选择了禁食状态作为生理学状态,胃pH被设置为恒值7(连续3天服用PPI后,健康受试者的胃pH值约为7)。根据受试者(平均体重83 kg)在禁食状态下进行100 mg剂量给药的平均PK特征,调整了分布和清除参数。最后,进行了参数敏感性分析,探究了胃通过时间在0.25~3 h的范围内,对吸收分数、血浆Cmax、Tmax和AUC的影响。
实测结果与模型预测结果
Figure 2描述了在禁食、饱食和联合PPI状态下口服100 mg速释胶囊后实测及预测的康奈非尼全身浓度,显示PBPK模型预测的结果与实测结果充分吻合。
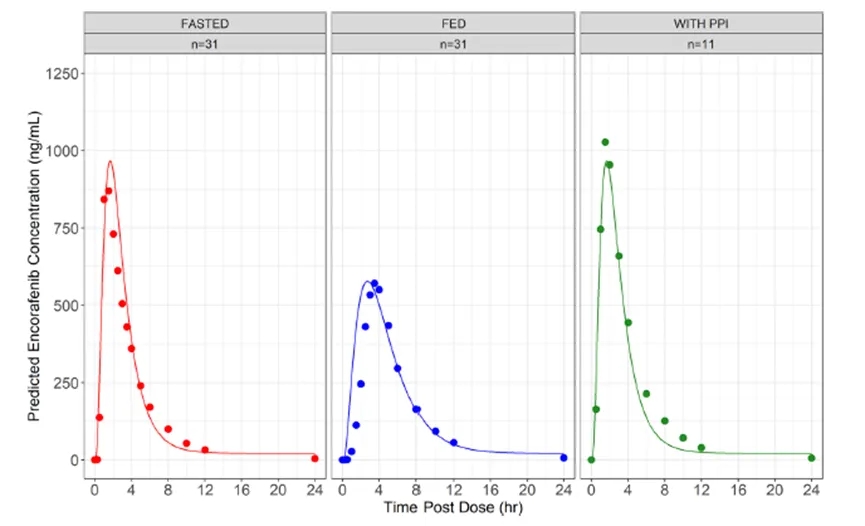
Figure 2. PBPK plasma predictions. Observed and simulated encorafenib exposures as a function of time following administration of a single 100 mg dose of encorafenib in fasted, fed, and fasted with coadministration conditions. Simulations are depicted by the solid lines, whereas the mean encorafenib concentration observed at each time point are depicted as dots. n = number of participants used to calculate the mean encorafenib concentration at each time point.
由于ASD的处方设计解决了药物溶解度差的问题,无定形康奈非尼的BCS分类可归于I类。对BCS I类化合物而言,吸收的限速步骤是胃排空率。因此,研究人员进行了参数敏感性分析(Figure 3),以确定胃排空对全身分配参数(即吸收分数、血浆Cmax、Tmax和AUC)的影响。结果表明,当给药剂量被完全吸收时,胃排空对吸收分数或血浆AUC几乎没有影响。而当胃通过时间增加时,血浆Cmax将会降低。换句话说,胃排空的延迟将会延迟吸收过程,从而导致血浆Cmax的降低,进而导致血浆Tmax的延迟。
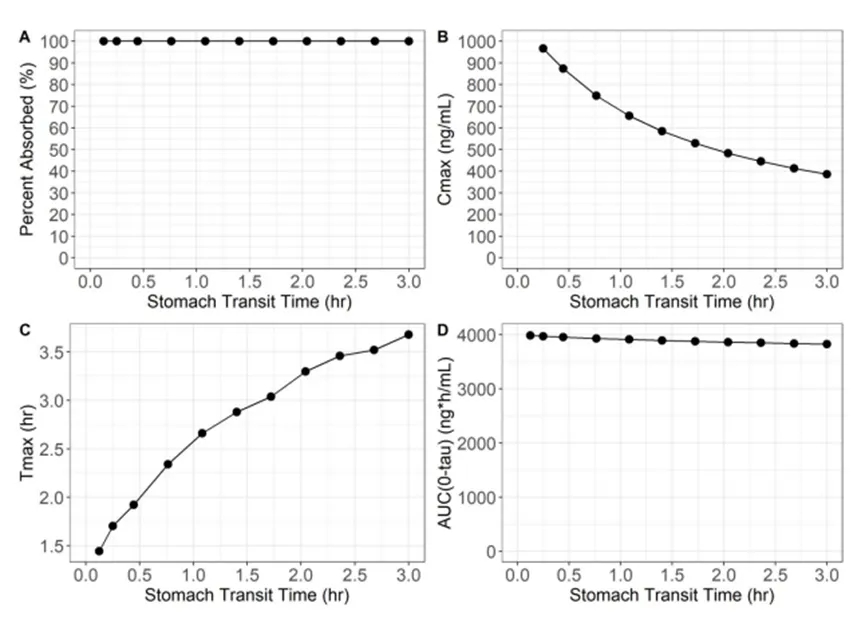
Figure 3. Stomach Transit Time Sensitivity Analysis: The outcome of a parameter sensitivity analysis in which stomach transit time varied from 0.25 to 3 hours. The impact of stomach transit time was explored on fraction absorbed, plasma Cmax, Tmax, and AUC for a 100 mg dose of encorafenib under fasted state conditions.
在研究的3种情况中,模型预测数据与实测数据均充分匹配,显示了康奈非尼在三种条件下100 mg给药剂量的完全吸收。康奈非尼无定形的溶解度数据(在pH 6.8时,无定形溶解度比晶型溶解度高20倍)是建模中的关键参数,ASD的处方设计绕过了该pH下化合物水中溶解度较低的问题,促进了吸收过程。
结论与总结
正如PBPK模型的结果所示,药物的溶出对吸收和渗透来说都不是限速步骤。处方的设计(如ASD)克服了溶解度和溶出有限的问题。聚合物PVP-VA的存在帮助药物在胃肠道内保持过饱和状态。无论在何种pH条件下,药物均可实现快速而充分的释放。因此,在胃酸缺乏的条件下(与PPI联用),与禁食条件相比,升高的胃pH对Cmax和AUC的临床PK参数没有产生任何负面影响。
在饱食状态下,胃排空率可能是吸收过程中的限速步骤,摄入的热量导致了胃排空过程的延迟(如参数敏感性分析所示),因此血浆Cmax和Tmax相比禁食状态,分别有所降低和增加。通过PBPK模型模拟的结果和参数敏感性分析,很好地揭示了饱食状态下实测PK的潜在机制。
根据本研究的结果,与禁食状态相比,饱食状态或联合使用减酸剂未对康奈非尼的暴露量产生有临床意义的影响。康奈非尼可在饱食或禁食状态下以临床推荐的剂量服用,且与减酸剂同时给药时,不需要调整剂量。PBPK模型结果与实测的康奈非尼临床数据高度一致。这表明,计算机预测工具将对未来康奈非尼新剂量和处方的开发有着重要价值。
GastroPlus®模型预测是晶云药物Mol2MedTM可开发性评价业务的重要部分。通过GastroPlus®软件建模,我们可以预测化合物的吸收情况,并鉴定影响化合物口服吸收的关键因素(如溶解度、粒径、剂量等),进而指导后续的策略制定。晶云药物Mol2MedTM可开发性评价业务针对先导化合物或候选化合物,利用有限的样品量和体内外数据,充分、准确地评估分子的理化性质,了解其开发潜力和风险。结合药物的靶点、适应症类型和用药途径等信息,判断固体形态(盐或游离态)和制剂的开发方向。晶云药物的处方前研究团队拥有丰富的可开发性评价和动物处方开发经验,在先导优化或候选化合物阶段了解其通过口服给药实现充分生物利用度的可行性,为PK/PD和GLP毒理动物实验开发最优处方,同时也为临床I期制剂策略制定和配方开发提供扎实的科学基础。
参考文献
[1] Dummer, R.; et al. Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2018, 19 (5), 603−615.
[2] Kopetz, S.; Grothey, A.; Tabernero, J. Encorafenib, Binimetinib, and Cetuximab in BRAF V600E-Mutated Colorectal Cancer. Reply. N. Engl. J. Med. 2020, 382 (9), 876−878.
[3] Vertzoni, M.; et al. Impact of regional differences along the gastrointestinal tract of healthy adults on oral drug absorption: An UNGAP review. Eur. J. Pharm. Sci. 2019, 134, 153−175.
[4] Assessing the Effects of Food on Drugs in INDs and NDAs – Clinical Pharmacology Considerations; Docket Number FDA-2018-D-4368; U.S. Department of Health and Human Services, 2019.
[5] Kesisoglou, F. Can PBPK Modeling Streamline Food Effect Assessments? J. Clin. Pharmacol. 2020, 60, S98−S104.
[6] Tistaert, C.; et al. Food Effect Projections via Physiologically Based Pharmacokinetic Modeling: Predictive Case Studies. J. Pharm. Sci. 2019, 108 (1), 592−602.
[7] Riedmaier, A. E.; DeMent, K.; Huckle, J.; Bransford, P.; Stillhart, C.; Lloyd, R.; Alluri, R.; Basu, S.; Chen, Y.; Dhamankar, V.; et al. Use of Physiologically Based Pharmacokinetic (PBPK) Modeling for Predicting Drug-Food Interactions: an Industry Perspective. AAPS J. 2020, 22 (6), 123.