

不论是从做药人对药物本身安全性考量,还是日趋严格的监管要求,手性药物构型都需要给予充分且完善的研究,必要时还需通过合成或者拆分的方法实现手性药物的单一(药用)构型的分离和提纯(手性纯度提升)。
结合晶云14年的手性拆分研究经验,本文将与各界同行分享手性拆分的意义和策略。依据固液平衡原理,深度剖析外消旋体的三元相图,为优先结晶和非对映体盐/共晶结晶拆分提供可行性思路,也通过实际的拆分案例解析非对映体盐拆分的关键要点。
内容导览
1. 手性的概念
2. 外消旋体类型判断
3. 手性药物构型研究重要性
4. 手性药物制备方法
5. 手性拆分主要类型
6. 基于固液平衡原理的手性拆分思路
7. 结语
1.手性的概念
手性,学术上定义为物体与其镜像不能重合的性质,就如同我们的左右手,互为镜像但不能重叠,一个物质若无法与其镜像重合,那它即为手性分子,与之互为镜像的分子即为对映体。一对对映异构体具有几乎完全相同的物理性质如熔点、沸点、溶解度、密度等,热力学性质如自由能、焓值等,以及化合物性质,相邻原子的排列完全相同,对应的固态表征如红外、拉曼、XRPD和DSC等在绝大多数情况下也会完全重叠,但旋光性存在差异,一个为左旋,一个为右旋,因此又被称为旋光异构体。
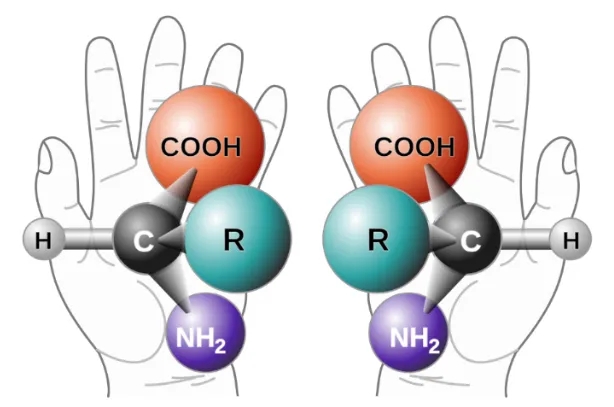
图 1 手性的概念
2.外消旋体类型判断
等摩尔的不同异构体之间的分子结合方式也将会带来三种类型的外消旋体,也就是本篇手性拆分的主角。
1)外消旋化合物-旋光性相反的异构体分子之间有更大亲和力,两种类型的分子以等量的形式共存于晶格中,形成均一结晶(某种意义上我们也可以理解为共晶),它的晶型表征图谱与纯异构体图谱存在较大差异,熔点多数高于纯异构体,而溶解度一般则更低,其在自然界中的占比约90%-95%。如下图2所示,二磷酸酯酶-4(PDE4)抑制剂的化合物1外消旋化合物与纯对映异构体在XRPD图谱上,显示多个衍射峰存在较大差异。
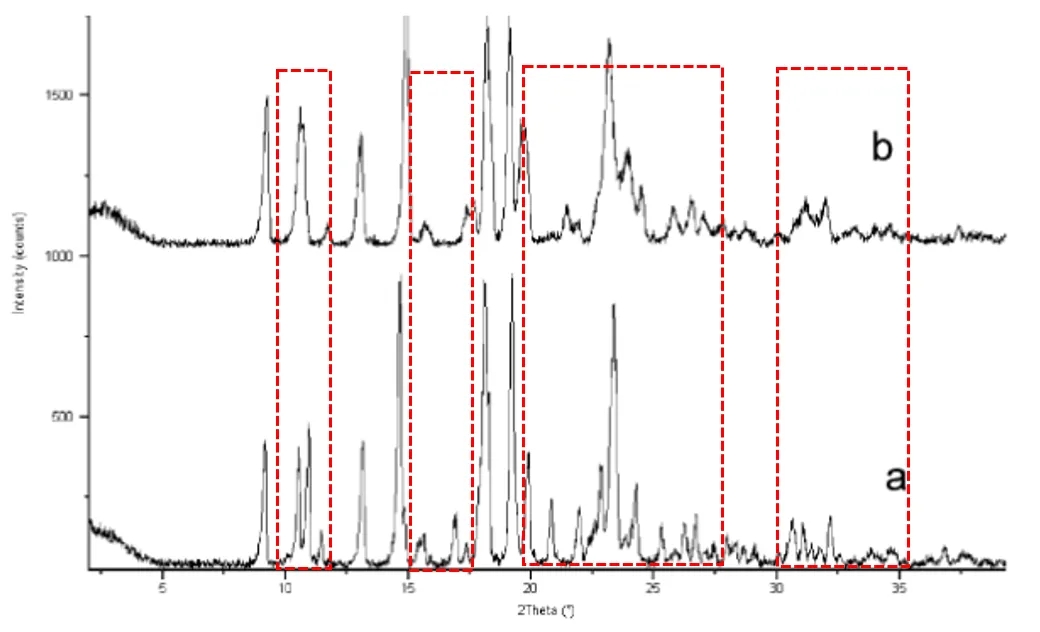
图 2 外消旋化合物(a)与纯对映异构体的XRPD图谱
2)外消旋混合物(聚集体)-同种旋光性的异构体之间亲和力更大,左旋体和右旋体各自以相同的方式堆积结晶形成晶体混合物,它的晶型表征图谱总与纯异构体图谱完全重合,熔点低于任何单一异构体组分,而溶解度则相对更高,其在自然界中的占比约5%-10%。
3)外消旋固体溶液-纯异构体之间与对映体之间的亲和力相近,两种构型的分子以任意比例相互混杂析晶,形成了一种固体溶液,其物理性质与纯对映异构体基本一致,但实际情况中出现它的比例很小。
3.手性药物构型研究重要性
目前了解到,世界范围内所使用的药物至少有50%以上为手性药物。对于手性药物而言,虽然其两个对映体具有相同的理化性质,但活性成分的分子必须与受体分子(比如受体蛋白或酶等)的空间几何结构适配才能发挥药效,由于药物本身存在手性异构,因此对应的两个异构体通常具有不同的生物活性。往往表现为以下几种类型:
1)两种构型的异构体具有相似或相同的药理活性,例如支气管扩张药特布他林,两种异构体都能选择性地激动气道β2受体,但R构型的药效强于S构型200倍;
2)一种构型有效而另一种构型无药理活性甚至起毒害作用,例如R构型的布洛芬临床表现为无任何药理活性且存在胃肠道毒性,“反应停事件”的主角S构型沙利度胺更是导致婴儿畸形而被“强制退市”;
3)药理活性不同形成药效互补,例如非阿片类镇痛药盐酸曲马多,两种构型分别发挥不同药效产生协同作用,临床上以消旋体给药效果更佳;
4)药理活性不同形成相互拮抗,例如苯哌啶类镇痛药哌西那朵,右旋为阿片受体激动剂而左旋为受体拮抗剂,同时给药将会产生拮抗作用而抵消药效。
“反应停”事件的发生敲响了整个医药界的警钟,引起来自社会以及监管层面对于手性药物两种构型研究的广泛重视。1992年FDA发布了关于手性药物的指导原则,要求在向FDA提交的有关新药申请报告中,必须包括对映体的化学、药理学、毒理学以及药代动力学所有相关信息以考虑以单一对映体或消旋体用药的问题。自此,也就衍生了学术界以及制药工艺界对于获得光学纯的手性药物分子方法的研究热潮。
2006 年12月国家食品药品监督管理局也发布了《手性药物质量控制研究技术指导原则》。在指导原则中规定:手性药物的质控项目要体现其光学特征的质量控制,要求对手性药物不同构性的生物活性(毒性)进行充分研究,并根据研究结果对产品进行质量控制。
4.手性药物制备方法
到目前为止,获取光学纯的手性化合物的方法主要有以下三类:
1)手性池合成:利用天然存在的手性分子作为原料,通过一系列的化学转化,最终得到目标手性产物。这种方法可以利用丰富的天然资源,如氨基酸、糖、核苷酸等,但可能存在步骤多、收率低、副产物多、合成产物受底物局限、成本高、不易实现工业化等不足。
2)不对称合成法:利用具有手性的催化剂,在反应过程中创造或控制手性中心的形成。这些催化剂可以是金属或有机分子以及生物酶,能够区分底物的不同手性面,从而导致手性产物的偏向生成。它可在多种反应类型中使用,但需要设计和制备特定的催化剂,存在成本和可用性以及工业化的问题。
3)手性拆分法:采用物理、化学和生物等多种拆分方法,将已存在的外消旋体通过分离纯化得到单一光学异构体。该方法成本低,操作简便易工业化,至今仍为工业上获得光学纯异构体的主流方法之一。但其局限在于拆分的理论产率在50%,若想要提升该理论产率则应在拆分的同时将不需要的对映异构体外消旋化,使其不断转化为需要的异构体,即将拆分和外消旋化同时进行,从而实现连续的拆分来提升理论产率。
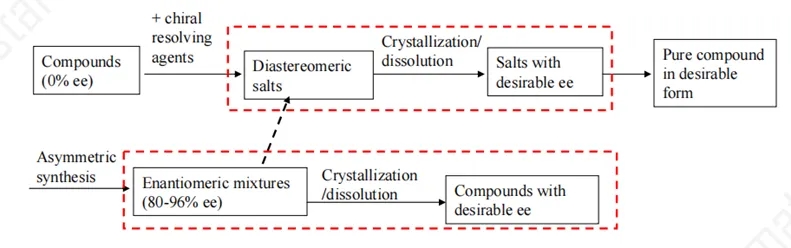
图 3 手性药物的主要制备方法
5.手性拆分主要类型
在前几期的文献分享中(文献解读第三期“Resolution of RS-Flx by Salt Formation with Oxalic acid”、第十一期“Resolution by Diastereomeric Salt Formation”),我们已经介绍过多种手性拆分的方法,主要包括手性色谱、结晶拆分、化学拆分以及生物酶/膜拆分等多种常用方式,不同方法的优势局限也进行对应说明,目前最常应用于工业生产当中的方法中主要为直接结晶拆分与化学拆分(又称间接结晶拆分),一个在于其技术成熟且成本低,同时也在于其应用范围广泛,适合于大规模工业生产且工艺稳定可控。
直接结晶拆分法:利用溶解度的差异,依据固液平衡理论,通过结晶的方法使得外消旋体中的理想异构体结晶析出,而另一种构型的异构体则保留在母液中,以此达到拆分的目的,此方法适用于外消旋混合物。对于外消旋化合物而言,也可以考虑通过成盐等衍生方法使其成为聚集体形式而实现拆分。根据不同结晶操作,结晶拆分又分为自发结晶拆分、优先结晶和逆向结晶等。
1)自发结晶拆分:此法来源于被誉为“化学界十大最美反应之一”的巴斯德拆分DL-酒石酸,通过两种不同构型的酒石酸在显微镜下能观察到不同晶向,实现人工拆分。此法要求两种不同构型的异构体结晶聚集体存在表观差异,因此应用存在较大限制。
2)优先结晶:如果在聚集体的饱和溶液中加入某种光学纯的异构体作为晶种,打破两种异构体结晶的平衡状态,即可实现单一构型的异构体优先结晶析出,即为优先结晶。这种方法已被广泛使用在学术研究以及工业应用当中。
3)逆向结晶:在聚集体的饱和溶液中加入可溶性的某种构型异构体,它将会吸附在溶液中同种构型的异构体晶粒表面,从而抑制晶粒的继续生长,实现相反构型的异构体先结晶析出。
化学拆分法(间接结晶法):以手性化合物与手性拆分试剂形成非对映异构体盐/共晶,以非对映体盐/共晶的不同晶体习性、理化性质(如表观溶解度)实现拆分。此法因其技术上简单易行,且易实现工业规模化而在手性药物拆分领域获得广泛应用。
6.基于固液平衡原理的手性拆分思路
6.1 外消旋化合物和外消旋混合物的二元/三元相图理解
首先,需要了解的是,在外消旋混合物体系中,最多存在两个固相-固相S和R,而在外消旋化合物溶液体系中,存在三相-固相S、R和外消旋化合物,因此在熔点两相图中以及溶解度三元相图中存在明显差异,即外消旋混合物存在一个共熔点(共组分点),而对应的外消旋化合物存在两个共熔点(共组分点),如下图4所示。构建相图也是前面所提到的通过图谱差异之外的鉴别外消旋体类型的最好方式。DSC方法可以很好地构建二元熔点相图,测不同构型混合比例的体系在溶剂中的溶解度可构建三元溶解度相图。由于R/S两种构型的异构体彼此之间理化性质几乎完全相同,所以在分析相图时往往可以取其一半进行分析。
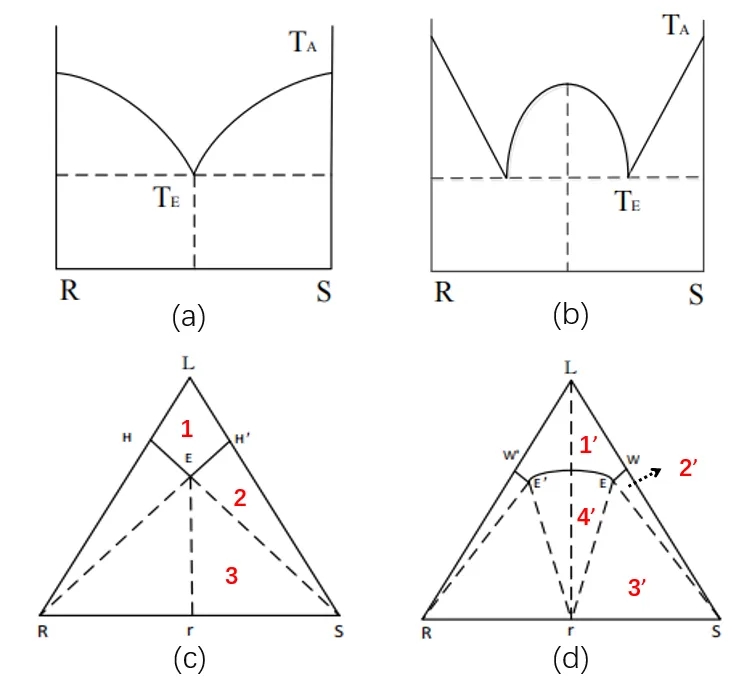
图 4 外消旋混合物及外消旋化合物的二元/三元相图
6.2 外消旋混合物三元溶解度相图
如图4c在外消旋混合物三元溶解度相图中,E为外消旋混合物体系的共组分点;线HE和H’E分别代表R构型和S构型在溶剂L中的饱和解度曲线;区域1位单相液相区,区域2表示在平衡状态下,R完全溶解在液相中,为固相S+液相的两相区,根据相律,在恒压的条件下,存在两个变量,所以当温度恒定时,上清液的组分随体系总组分变化沿EH’变化;区域3表示在平衡状态下为固相S+R+液相的三相区,根据相律,在恒压的条件下,仅存在一个变量,所以当温度恒定时,上清液的组分是固定的,由共组分点E表示,与体系总组分无关。
6.3 外消旋化合物三元溶解度相图
如图4d在外消旋化合物三元溶解度相图中,E’和E为外消旋化合物体系的共组分点;线和W’E’、WE和E’E分别代表R构型、S构型和外消旋化合物在溶剂L中的饱和溶解度曲线;区域1’为单相液相区,区域2’为固相S+液相的两相区,区域3为液相+固相S和外消旋化合物的三相区;区域3’为固相外消旋化合物+固相S+液相的三相区,根据相律,在恒压的条件下,仅存在一个变量,所以当温度恒定时,上清液的组分是固定的,由共组分点E表示,与体系总组分无关;区域4’为固相外消旋化合物和液相的两相区。在结晶过程中,如果我们调整操作参数把结晶控制在2和2’区域内,及控制溶液的R组分的组成不能超过共组分点E的组成,即理论上可以实现S构型的单独结晶析出。
7.结语
基于结晶方法学的手性拆分是获得光学纯手性药物的主要方式之一,而在这个过程当中,理解三元相图的含义有利于帮助我们去做正确的决策。例如对应不同类型的外消旋体选择何种结晶方式拆分,拆分过程中的参数如何调整,都需要建立在理解原理的基础上,实现更好的应用,上述问题我们会在第二篇手性拆分文章中深入探讨,也请大家持续关注后续系列文章。
参考文献
1. Chen A M , Wang Y , Wenslow R M .Purification of Partially Resolved Enantiomeric Mixtures with the Guidance of Ternary Phase Diagram[J].Organic Process Research & Development, 2008, 12(2):271-281;
2. Wang Y , Chen A M .Enantioenrichment by Crystallization[J].Organic Process Research & Development, 2008, 12(2):282-290;
3. 王波.缬沙坦的手性拆分和稳定性的结晶工艺研究[D].华南理工大学,2017;
4. Lorenz H , Perlberg A , Sapoundjiev D ,et al.Crystallization of enantiomers[J].Chemical Engineering & Processing Process Intensification, 2006, 45(10):863-873;
5. 王耀国,赵绍磊,杨一纯,et al.手性药物结晶拆分的研究进展[J].化工学报, 2019, 70(10):12;
6. Lorenz H , Seidel-Morgenstern A .Binary and ternary phase diagrams of two enantiomers in solvent systems[J].Thermochimica Acta, 2002, 382(1-2):129-142.