

2023年,FDA共批准55款新药 [1],包含38款新分子实体,其中30款为小分子新药。从给药途径和剂型来看,在这30款获批的小分子新药中,5款为液体制剂(其中包括2款注射制剂,3款滴眼剂),1款为鼻喷剂,24款为固体/半固体制剂(其中包括23款固体制剂,1款凝胶剂),如下表1。
表1. 2023年FDA批准的38款新分子实体基本信息
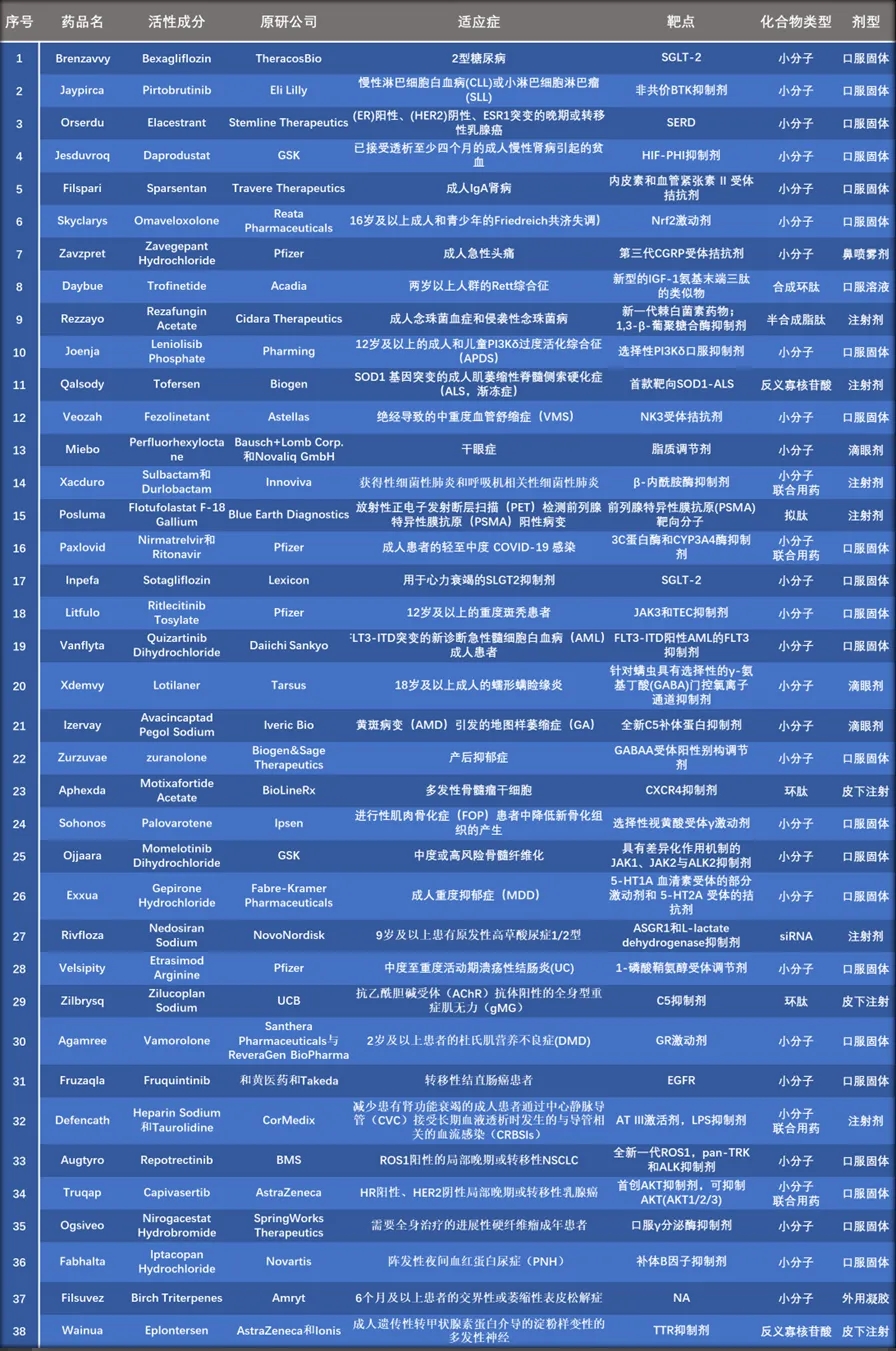
通过对24款固体/半固体制剂小分子新药的原研公司专利布局分析发现,共有20款产品已经布局了晶型专利(统计包括正在审查中的专利),占所有固体制剂/半固体制剂小分子新药的83%,具体信息见表2。
表2. 24款固体/半固体制剂小分子新药的基本信息及晶型专利布局
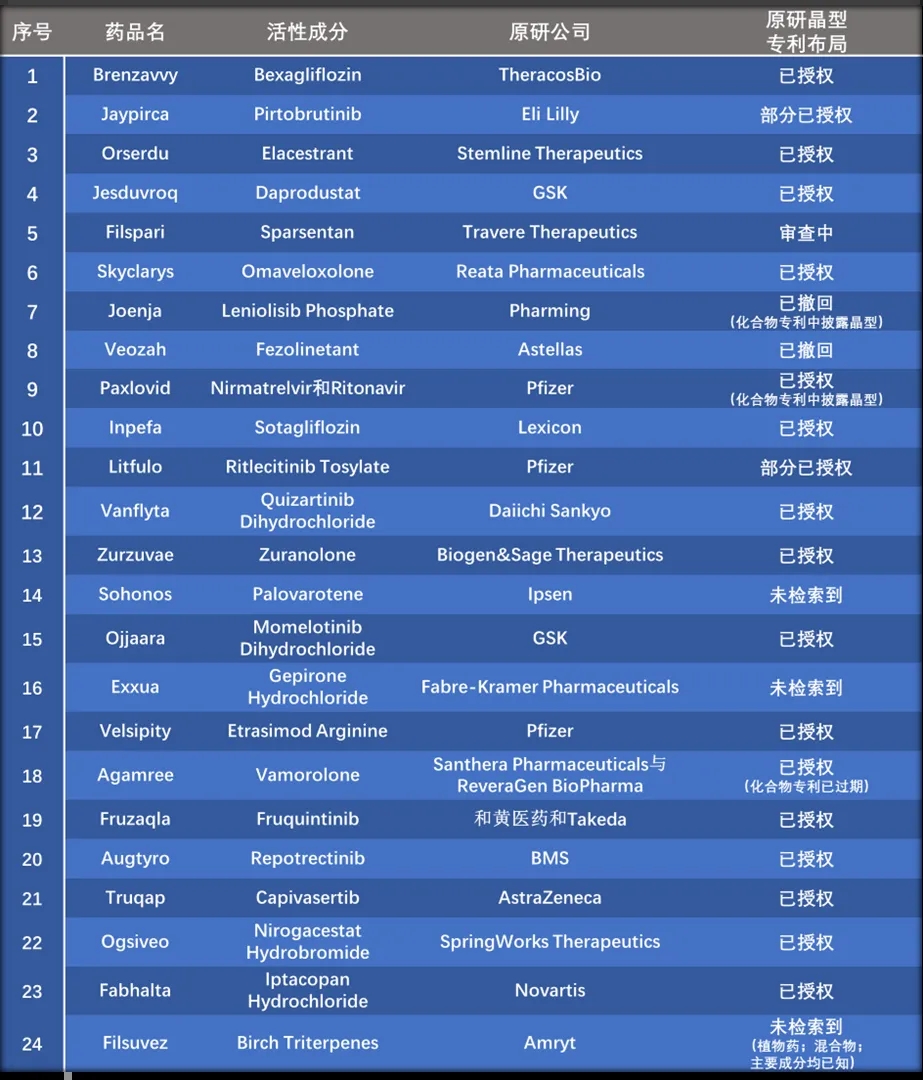
针对上述20款原研已有晶型专利布局的小分子新药,我们进一步分析了其化合物专利和晶型专利过期日及二者的时间差,结果见表3。3款品种(Jaypirca、Filspari 和Litfulo)因晶型专利还是审查阶段,未计算其专利时间差;另外2款品种(Joenja和Paxlovid)因晶型相关信息已在化合物专利中披露,无专利时间差;剩余15款品种原研晶型专利过期日均晚于化合物专利过期日,且晶型专利过期日和化合物专利过期日的时间差均大于1年,其中时间差在3年(含3年)以上的有11个品种,时间差在5年(含5年)以上的有8个。值得注意的是,Orserdu,Agamree和Ogsiveo这三个品种因晶型专利的布局而增加了长达10以上的专利保护期。
表3. 20个小分子新药的化合物专利和晶型专利分析
小编从上述20个品种中选取3个品种作为代表,进行详细介绍,以帮助读者更好理解创新药公司如何通过晶型专利布局延长产品生命周期。这3个品种的获批也极具里程碑式的意义,无论是从治疗疾病本身还是市场份额预估,都具有成为重磅品种潜力。
Skyclarys
Skyclarys (Omaveloxolone)是由Reata Pharmaceuticals研发的用于16岁及以上弗里德赖希共济失调(FA,Friedreich ataxia,一种神经发育和进行性神经退行性疾病,是神经共济失调中最常见的遗传形式)的处方药,也是迄今唯一一款获得FDA批准的该类药物。它旨在激活核因子红细胞系2相关因子2(NrF2,可激活促进线粒体功能、增强抗氧化反应和预防炎症的基因促进线粒体功能、增强抗氧化反应和预防炎症的基因),帮助恢复FA患者中受损的信号传导从而恢复线粒体功能。2023年2月28日,Reata Pharmaceuticals宣布美国FDA已批准Skyclarys上市,该疗法有望减缓弗里德赖希失调的疾病进展。
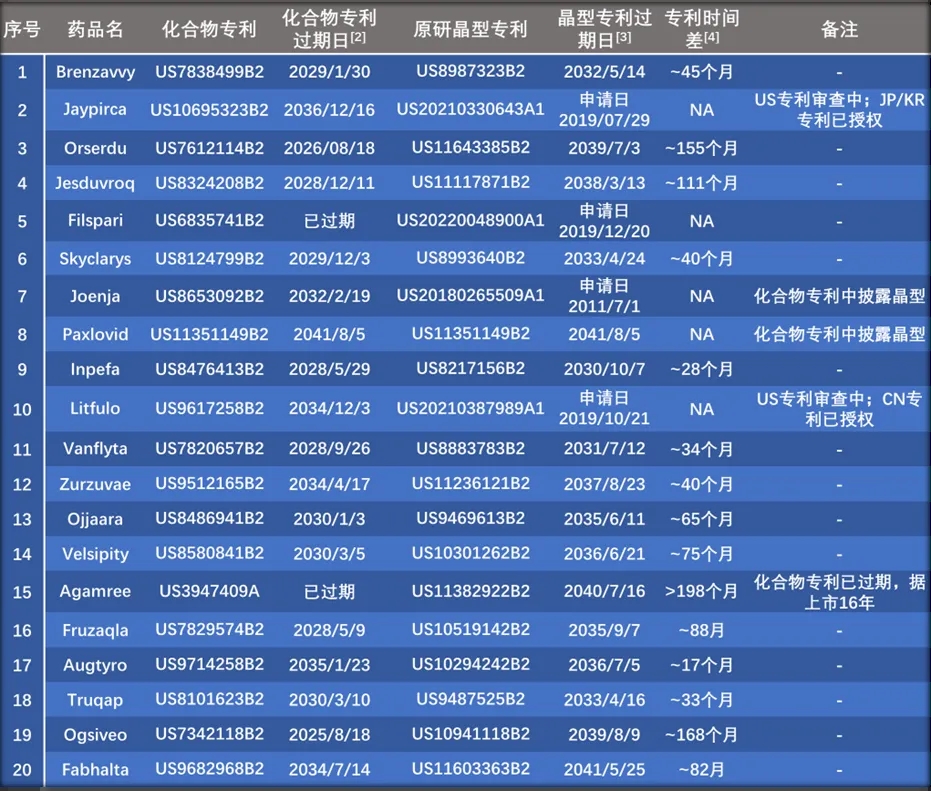
上市产品中的药物活性成分为结晶形式的Omaveloxolone,其化合物专利(US8124799B2)将于2029年12月3日过期,晶型专利(US8993640B2)披露了Omaveloxolone的无定形和几种溶剂合物/水合物晶型,过期日为2033年4月24日。原研公司在该药物晶型专利上的布局使得该药物在化合物专利过期后仍有约40个月的专利保护期。
Zurzuvae
Zurzuvae (Zuranolone)是由Biogen和Sage Therapeutics合作开发的一款用于治疗产后抑郁症(PPD,Post-Partum-Depression)的口服胶囊。产后抑郁症是妊娠期间和妊娠后最常见的并发症之一,发病率为15%-30%。虽然目前已有多款抗抑郁药物上市,但这些药物普遍需要较长时间才能看到具有临床意义的应答,同时还需考虑到女性激素变化以及哺乳等因素。Sage开发的同类型药物别孕烷醇酮(Brexanlone)是首个获得FDA批准的治疗PPD药物,但该药物采用单次60小时静脉滴注,患者依从性较差,且治疗费用高。Zurzuvae 是一种神经活性类固醇γ-氨基丁酸A型(GABAA)受体阳性别构调节剂,具有高口服生物利用度,且治疗费用大大降低。2023年8月4日,Biogen和Sage Therapeutics联合宣布美国FDA已批准Zurzuvae上市,该疗法可快速缓解PPD患者的症状。
上市产品中的药物活性成分为结晶形式的Zuranolone。其化合物专利(US9512165B2)将于2034年4月17日到期。晶型专利(US11236121B2)披露了化合物Zuranolone从晶型A至晶型P的多个晶型,包含无水晶型、水合物及溶剂合物等,过期日为2037年8月23日。原研公司在该药物晶型专利上的布局使得该药物在化合物专利过期后仍有约40个月的专利保护期。
Ogsiveo
Ogsiveo(Nirogacestat Hydrobromide)是由SpringWorks Therapeutics研发的第一款针对成年硬纤维瘤患者的口服片剂。它是一款特异性γ-分泌酶小分子抑制剂,γ-分泌酶能够切割多种跨膜蛋白复合体,其中就包括Notch蛋白(其被认为能够激活导致硬纤维瘤生长的信号通路),通过抑制γ-分泌酶的活性阻断Notch信号传导。2023年11月28日,SpringWorks Therapeutics宣布美国FDA已批准Ogsiveo上市,用于治疗需要全身治疗的进行性硬纤维瘤成年患者。也是FDA批准的第一个专门用于韧带样瘤的药物。
上市产品中的药物活性成分为Nirogacestat Hydrobromide,开发的药物固态形式为氢溴酸盐晶型。Ogsiveo化合物专利(US7342118B2)2025年8月18日到期,晶型专利(US10941118B2)于2039年8月9日到期,其中披露了化合物Nirogacestat Hydrobromide从晶型A至晶型N的多个晶型。值得注意的是,原研公司通过该药物晶型专利上的布局使得该药物在化合物专利过期后仍具有长达14年的专利保护期。
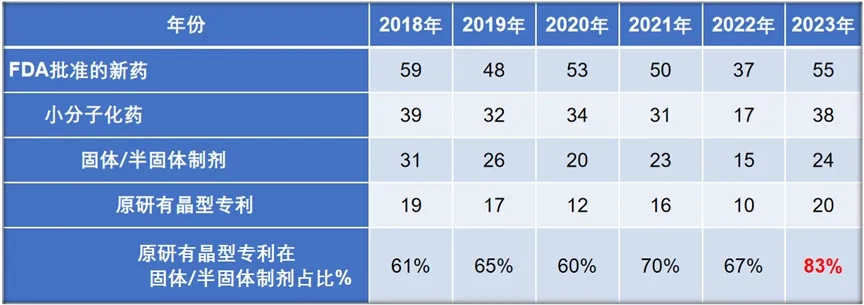
回顾近6年的数据(表4),除2022年外,FDA每年获批新药在40-60个之间,其中小分子新药占据30-40个,而口服固体制剂小分子新药在20-30个之间。去年医药行业经历寒潮,虽然生物医药产业在今年仍面临着诸多变化,但保持信心,特别是今年的小分子新药获批情况逐渐回暖,回到了2018-2020年的高峰数量。在固体/半固体制剂的小分子新药中,原研晶型专利布局的产品比例从前五年的60%至70%上升至今年的83%。这表明业界对药物固态性质的研究和晶型专利的申报越来越重视,不管是归因于监管层面越来越严格的审评要求,还是归因于在研究过程中确实发现晶型会导致一系列问题,总体而言,这是一个积极的进展。
表4. 近6年FDA批准新药的晶型专利保护情况
由此可见,对于药物晶型的研究和晶型专利布局一直都是大多数创新药公司在新药开发过程中关注的重点。一方面是因为药物晶型直接对药物稳定性、工艺可开发性以及生物利用度产生影响,是新药开发中不容忽视的研究内容,是监管部门在批准小分子新药时尤其关注的研究重点;另一方面,对创新药企业来说,药物晶型专利保护有助于建立更高的技术壁垒来抵御仿制药企业的竞争,延长新药的保护期,从而获取更高的市场经济效益。因此,药物晶型的研究和晶型专利布局对于创新药企业而言具有重要意义。
晶云药物深耕小分子药物晶型研究多年,不仅能为客户药物晶型筛选、可开发性评估等固体研究研发服务,还能基于药物不同的研发,提供多种晶型专利申报和分析相关服务,包括晶型专利策略分析、可专利性评估、技术研究方案制定等全方位的解决方案,具体如下表5。
表5. 晶型专利申请相关服务
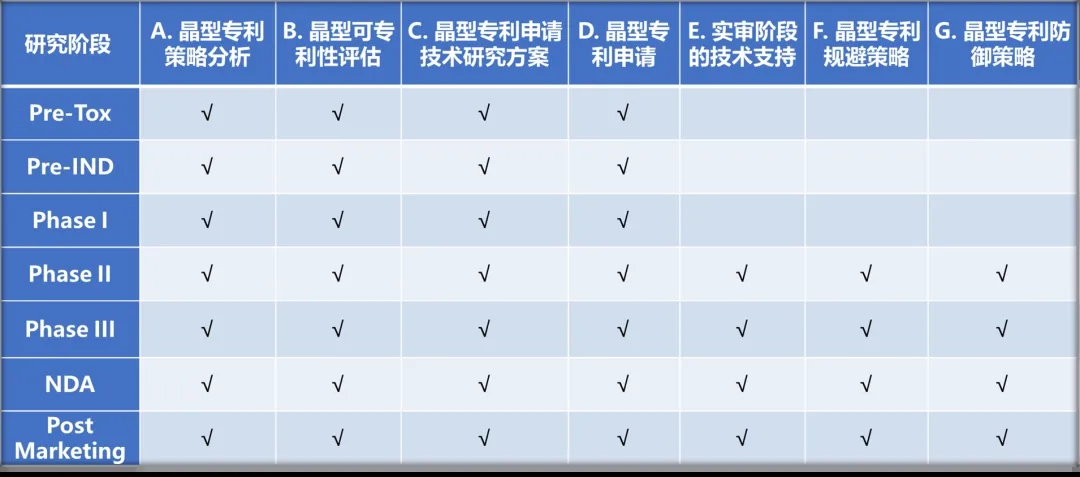
备注:服务项目A-D可整合为一个项目,或作为晶型筛选项目的一个可选模块