

内容导览
1. 碳酸镧简介
2. 碳酸镧原研杂质的定量研究
3. XRPD定量分析方法的选择
4. 如何开展碳酸镧定量分析
5. 小结
1
碳酸镧简介
碳酸镧,英文名Lanthanum carbonate,商品名FOSRENOL,为Shire制药(目前属于日本武田制药)研发的新一代不含铝和钙的磷结合剂,已上市剂型为咀嚼片,其中活性成分为四水合碳酸镧,用于血液透析或持续非卧床腹膜透析(CAPD)的慢性肾功能衰竭患者高磷血症的治疗。
2021年12月底四川自豪时代药业的碳酸镧咀嚼片以新4类仿制药获批上市,紧接着湖南明瑞、正大天晴、青神虹豪、沈阳福宁药业均依次获批生产,而目前以3类仿制药提交上市申请的碳酸镧颗粒制剂品种还暂未获得通过。国内原料药企业已有20家备案了碳酸镧的原料药,其中原料药已经转“A”的4家企业均为制剂已过一致性评价的制剂企业(自豪时代、明瑞、正大天晴和福宁)。
2
碳酸镧原研杂质的定量研究
原研Shire制药最早公布了用于治疗高磷血症的药物组合物专利(US5968976A),包含系列水合碳酸镧La2(CO3)3·xH2O(该水合物的常见形式具有大约3至5个水平均x个水)。目前已上市制剂品种中原料药主要成分为四水合碳酸镧形式,而它在如高热高湿等某些严苛条件下容易脱羧基而形成碱式碳酸镧降解产物(碱式碳酸镧多晶型I和多晶型II形式),如下公式所示:
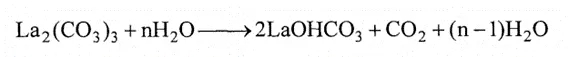
同时,此反应类似自催化反应,即极小量的碱式碳酸镧的存在都会加速碳酸镧产品的降解速率。并且,在制造工艺以及后续储存过程中均可能引入脱羧基产生降解产物的条件。因此,按照监管要求需开发原料药及制剂中可能存在的碱式碳酸镧的定量分析方法来监控。通常情况下考虑色谱技术来实现定量,如HPLC,但落在这个品种上不太现实。这是因为水合碳酸镧和碱式碳酸镧均不溶于水和标准有机溶剂,虽可溶解在含水的酸性体系中,但二者产生相同的盐,无法实现区分;而采用滴定法通过滴定所得盐溶液中的镧含量,也因二者的镧含量非常类似,无法准确定量。
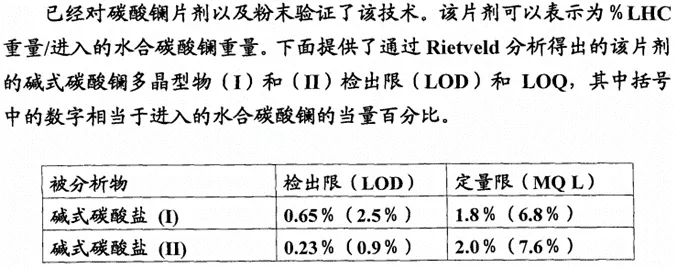
原研开发了Rietveld全谱拟合的XRPD定量分析方法对碳酸镧及对应制剂中原料药的晶型进行检测分析。如下图所示,在原研的标准中,分别对原料药和制剂中,碱式碳酸镧晶型I和II的质量标准进行了约定。
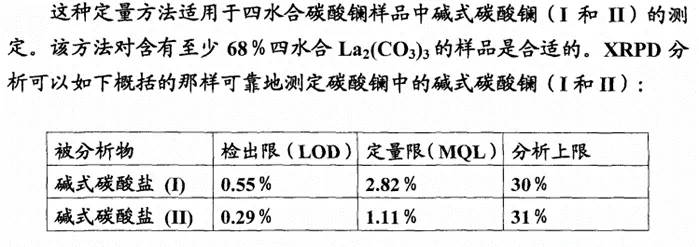
图1 原研专利中碳酸镧原料药中碱式碳酸镧晶型的LOD和LOQ标准
3
XRPD定量分析方法的选择
基于XRPD的定量分析方法又包括全谱拟合法和单峰法。
全谱拟合法依赖于将实测谱图与计算谱图进行比较,并通过最小二乘等方法使二者间的差异最小化,从而实现物相含量的定量,包括Rietveld类方法,全谱分解法,化学计量法等。而单峰法依赖于对目标物相的某一个或某一组特征衍射峰的强度进行测量,包括外标法,内标法,参考强度比值法(RIR法),矩阵冲洗法等。
在实际研究中,单峰法的运用相对简单,对样品的要求较低,灵敏度也相对较高,较全谱拟合法的适用性更广。
4
如何开展碳酸镧定量分析
综合对多种定量方法的评估考量,晶云药物团队选择了单峰法中的绝对强度法来开展碳酸镧品种的定量分析研究,在有效减少测试时长的情况下也能达到原研专利中LOD和LOQ的质量要求。
方法开发阶段
1) 样品表征:收集各样品的基础表征,以了解样品基本理化性质,便于评估混样难度;随后开展晶型对照品的标定,确认杂质晶型对照品不含参比谱图(专利数据、单晶数据拟合图等)以外的其他衍射峰。
2) 混粉样品制备:混粉样品的均匀性是方法开发和验证的基础,需要格外重视,在前一步样品基础表征后,进行标准曲线样品的配置,浓度范围根据目标定量范围确定。晶云药物采用了3D物料混合仪进行机械混合以代替人工,具有较好的重现性,并极大节约人工成本。
3) 特征峰选取:在考虑专属性的同时,也需要关注所选特征峰强度是否稳定,结合特征峰互相不干扰的原则,初步选出可用作定量分析的特征衍射峰。以预设的扫描方法和时长,收集主要晶型和杂质晶型对照品以及辅料特征峰范围内的高分辨XRPD衍射数据,如下图4所示。
4) 测试参数调节:对定量方法开发影响最大的参数为扫描范围及每步扫描时间,次重要参数为发散狭缝宽度及扫描步长。具体参数调节需要根据具体项目背景综合考虑设置。在此项目中,调节参数至LOD和LOQ对应浓度下杂质晶型的特征峰信噪比能满足要求,参数即可基本确定。
不同于液相定量分析中溶液成分的易混合,整个固态定量方法开发过程中尤其需要关注混粉样品的均匀性,在发现混样均匀性较差的情况下需要对样品进行前处理等方法来解决。
方法验证阶段
根据《药品晶型研究及晶型质量控制指导原则》,采用的晶型定量分析方法应符合《药品质量标准分析方法验证指导原则》的准确度、重复性、专属性、定量限、线性、范围、耐用性等内容相应要求(见图3)。
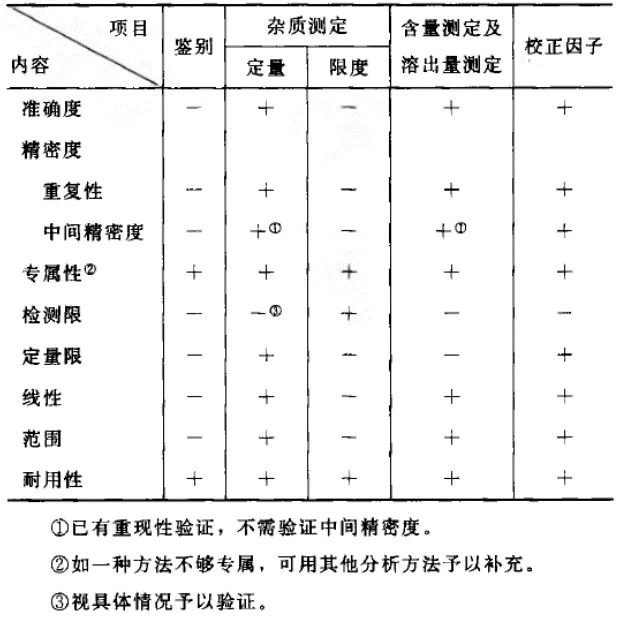
图3《药品质量标准分析方法验证指导原则》中关于定量研究的验证项
与液相定量分析方法类似,对应的验证项在对不同浓度的标准品进行重复测试时均需达到相应的RSD,线性R2的要求。
最后,验证通过后的方法也能实现不同类型及型号的XRPD仪器的成功转移。
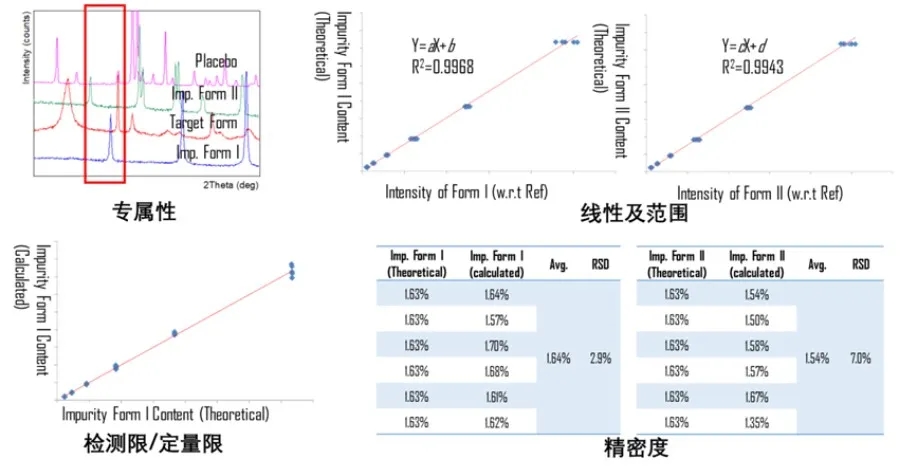
图4 碳酸镧定量项目中的方法验证
5
小 结
回到碳酸镧品种本身,从原研的方法延伸到后续研究者的方法,历经了多种定量方法的选择,LOD和LOQ要求的制定及匹配,大到完整方法的建立,小到样品混合,除了依赖于分辨率高性能好的仪器设备,也更基于研究人员对于定量方法的基本原理、流程思路、过程分析等各个方面的了解和熟悉。
另外,从药品监管层面,杂质晶型的定性、限度和定量研究分别在什么阶段开展以及需要开展到什么程度,我们已在往期的推文中分享过一些经验和建议(见【晶云·分享】晶型定性定量研究知多少?)。那对于晶型的全定量研究,我们最关注的LOD、LOQ等参数应该定到什么标准,是否有相应的一些既定标准或者经验呢?限度是否越低越好?
对于仿制药而言,质量标准须严格参考原研专利制定;对于创新药而言,质量标准需结合多晶型研究情况,以及参考其他研究结果(如溶出试验、生物等效性研究等、药效、安全性考察等)综合确定。
在过去几年里,晶云药物已积累多个各类型碳酸镧品种的全定量研究项目经验。在药物晶型定性和定量分析方面,晶云药物具有丰富的开发经验,已为数百家客户完成超过300个品种的制剂中晶型定性研究,超80个晶型定量研究项目。晶云药物采用XRPD方法开展原料药和制剂中晶型定性、定量研究,除常规片剂、胶囊晶型定性定量分析外,还成功开展干混悬剂、软膏剂、贴剂、粉雾剂、喷雾剂、混悬剂等剂型的研究。面对日益严格的监管需求,晶云药物希望用更专业的技术、更有效的沟通,来支持广大客户不同阶段的定量研究相关需求!