



本文献通过研究数据表明,非对映体盐结晶拆分在外消旋布洛芬的手性拆分中具有高效快速、简单易行、且易实现工艺放大等多种优势,在手性药物拆分中具有广泛的应用价值。同时,也深入研究了拆分过程中不同关键因素对拆分效果的影响,为后续非对映体盐结晶拆分的实际应用提供了参考思路。
原文链接
https://doi.org/10.1021/acs.iecr.2c04290
手性拆分,顾名思义即将手性化合物不同构型的异构体通过物理或化学的方法拆开并实现分离。在目前临床上所使用的小分子药物中,有60%以上是至少含有一个手性中心的手性化合物,而其中约88%在十五年前是作为外消旋物上市的。虽然目前的法规仍然为使用外消旋物敞开着大门,但前提是需要有证据表明所使用的外消旋物具有临床治疗优势,即当一种对映体具有所需的药理活性时,另一种构型的对映体可以是起协同作用的、非活性或生物惰性的,但不能是拮抗作用以及生物有害的。所以在后期药物开发阶段,如果发现手性药物的异构体具有拮抗作用或导致治疗效果降低、产生生物毒性,则必须开发一种高效的拆分方法来获得光学纯的活性异构体化合物。
(1)不对称合成法:常采用生物催化剂(如酶)、手性催化剂、手性池来制备单个对映体。由于催化反应固有可逆性会导致反应时间延长、选择性不足,从而使得该技术存在收率低、成本高、催化剂不稳定、难以工艺放大的等缺点;
(2)动力学拆分:以外消旋混合物为起始,通过不同对映体与手性试剂或酶的反应速率不同实现拆分。但往往会受到反应程度的影响而很难得到高ee%(enantiomeric excess,对映体过量)的异构体产物;
(3)色谱分离法:如HPLC、GC、 薄层色谱、毛细管电色谱、超临界流色谱、模拟移动床色谱等。在研发早期阶段常采用这种方式来分离手性化合物,但其成本太高,不适用于工业规模;
(4)优先结晶法(PC):一般针对于外消旋混合物(又称聚集体conglomerate,两个相反构型的纯异构体晶体的物理混合)会采用这种技术实现拆分,即在外消旋混合物的过饱和溶液中加入目标异构体晶种诱导其优先结晶析出。但对于外消旋化合物而言需要匹配合适的诱导体(如非手性的酸或碱等)变为聚集体才能进行拆分(而外消旋化合物存在比例为80%-90%,远高于聚集体);
(5)非对映体盐结晶拆分:以手性化合物与手性拆分剂(手性酸或碱等)形成非对映异构体盐,因非对映体盐具有不同的晶体习性、物理化学性质(如表观溶解度)等实现拆分。当然此法的先决条件在于给定的手性化合物需具备成盐特性。对于难成盐的手性化合物,也可以考虑采用成共晶的方式实现拆分(类似成盐)。这种技术相比较而言简单易行,且易于实现工业规模化生产,在药物研发中得到广泛应用;
(6)膜分离技术:选择性膜一般由选择性载体、手性选择器、捕获酶或蛋白质等组成,具有可连续操作、成本低且易于放大等优点,但存在质量传输慢,选择性较低和膜稳定性等局限。
本文中Hung Lin Lee课题组即采用非对映体盐结晶拆分的技术实现外消旋布洛芬 (RAC-IBU)的手性拆分。前期布洛芬推文中已提及(《布洛芬记——“Molecule-Material-Medicine”》),左旋布洛芬会引起胃肠道毒性、水钠潴留等诸多副作用,且体内不易代谢,而已上市品种中多为外消旋布洛芬。课题组系统性的研究了布洛芬手性拆分的三个步骤:1)非对映体盐形成;2)冷却法重结晶;3)反溶剂结晶回收,考察了如当量比、溶剂体系、温度范围及反溶剂添加速率在内的多种因素对拆分效率的影响,并通过这种成本低、高效快速、操作简单、可实现工艺规模化的拆分方法以高收率(95%),较高ee值(80%)获得S-布洛芬。
Figure 1. Workflow of the Present Study.
(1)非对映体盐的形成:根据文献调研结果,选择S-MBA((S)-(−)-α-甲基苄胺)作为拆分剂。先将RAC-IBU高温下溶解于纯水或者KOH溶液中,完全溶清后滴加S-MBA继续搅拌,加完后冷却至25 oC搅拌析晶,形成的两个非对映体盐具有更高的熔点且不溶于水。
(2)冷却法重结晶提高de%(diastereomeric excess,非对映体过量):所形成的非对映体盐在两种温度范围下,在7种相对较好的溶剂体系中重结晶-在较高温度下配置饱和溶液,搅拌平衡后冷却至25 ℃结晶析出。
(3)反溶剂结晶法回收:先测定25 ℃下非对映体盐在几种溶剂体系中的平衡溶解度。根据测定的溶解度,将重结晶后的非对映体盐晶体溶解于对应溶剂中配制近饱和溶液,加入硫酸裂解,再以恒定速率加入反溶剂水使游离的S-IBU析晶分离。(1)拆分剂当量比:通过对比不同当量比的RAC-IBU, S-MBA, KOH实验组de%,固体产率(相对于理论形成的非对映体盐)以及S盐的回收率发现:不加碱对于非对映体盐的拆分没有效果,随着碱当量提升,de%影响提高,这表明KOH的存在可能:a)扩大非对映体S盐和R盐的溶解度差异,b)通过改变S-和R-IBU、S-MBA和KOH之间的平衡,利于S-IBU和S-MBA在电离态下的相互作用;拆分剂S-MBA的当量越高,对应固体产量越高;权衡二者的值,最终选取RAC-IBU:S-MBA:KOH=1:0.5:0.5的当量比,能获得最大收率的S-盐。
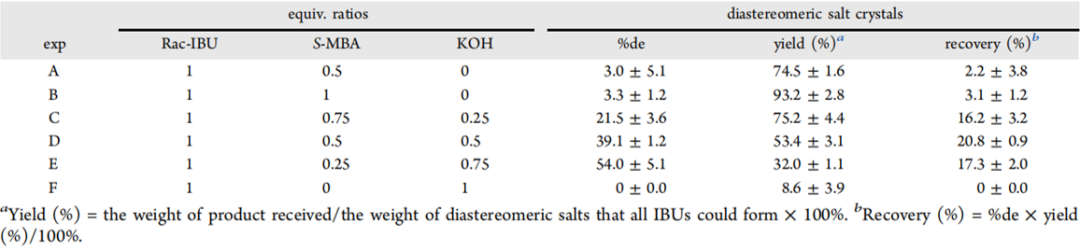
Table 1. 不同当量比拆分剂对于形成的非对映体盐的de%、产率和回收率的影响
(2)冷却结晶所用溶剂及温度范围:基于ICH指导原则及前期溶剂筛选研究,选取了包含丙酮、甲醇、乙酸乙酯在内的以下7种溶剂,温度范围选择40-25, 50-25, 60-25, 70-25等4个区间。如图1所示,不同冷却条件,de%均有明显提升,但不同溶剂体系间的差异较小;但通过扩大冷却温度范围(如图2),使得产率大大提升,从而提高了图3中S-盐的回收率,由此可推测,冷却温度范围是提高非对映体结晶产率的一个重要因素。结合图4中测得的de%~40%-50%的非对映体盐在不同溶剂中平衡溶解度数据(EA中溶解度最低),以及不同de%的非对映体盐在EA中的溶解度趋势(图5,de%增高,溶解度降低),也优选出EA作为冷却结晶法的最佳溶剂。
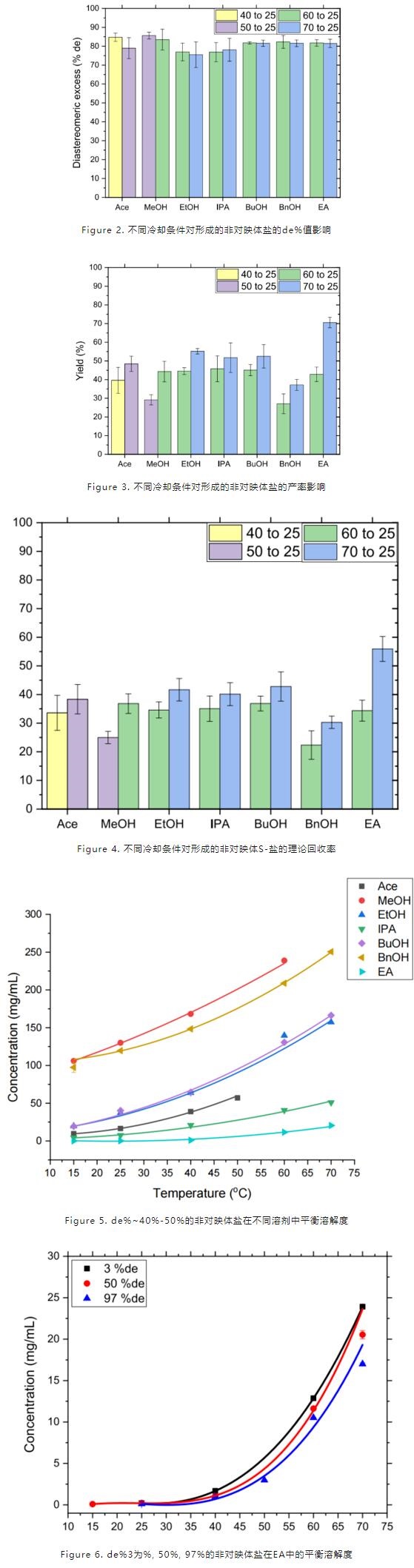
(3)正反溶剂比例:冷却结晶法得到de%优化的非对映体盐后,破盐获得S-IBU,其在溶剂中的溶解度高于非对映体盐(对比图4和图6),因此在回收S-IBU时可采取反溶剂添加作为析晶方式。先选择正溶剂MeOH溶解非对映体盐(绿色溶剂,且溶解能力最强),随后加入2 mol/L 硫酸保证破盐完全,然后在25 ℃条件下加入不同比例的纯水。
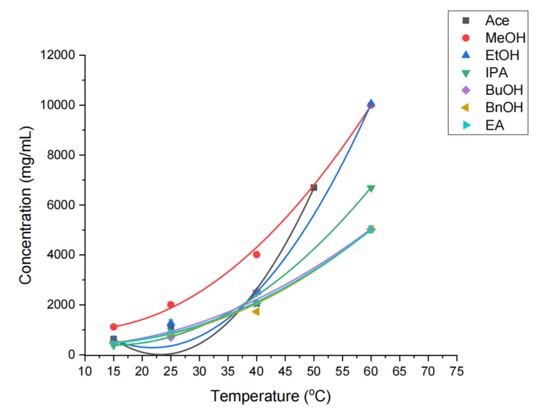
Figure 7. RAC-IBU在不同溶剂中平衡溶解度
虽然在25 ℃ 下,RAC-IBU和S-IBU在不同比例的甲醇-水混合溶剂的溶解度显示,比例为1:1时,溶解度即降到极低(如下图8),但实际反溶剂添加过程中发现(如下表2):水添加的比例达到2时仍然没有固体析出,可能是因为过量的硫酸或S-MBA硫酸盐的存在导致IBU的溶解度增大。水比例达到1:3时产率仅为48%,而提到1:6时产率上升到85%。同时,也在析晶过程中发现液-液相分离现象(LLPS,也是常见的油析现象),这种现象在正反溶剂比例为1:3时最为明显,这可能是因为IBU本身的低熔点和在甲醇中的高溶解度,通过搅拌或混合与水相共存而使IBU溶剂包裹于甲醇中,从而形成油滴。油析现象形成将会影响结晶终产品的纯度、产量等,也会导致产生凝胶状产品影响后续分离或处理。改善这种现象可以通过a)增加起始物料纯度、减小浓度;b)添加反溶剂以绕过LLPS区域;c)改变溶剂体系;d)在亚稳区添加晶种诱导溶液或液滴的成核生长;e)降低反溶剂添加速率等多种方式。这也就能解释清楚表2和图8的数据差异。
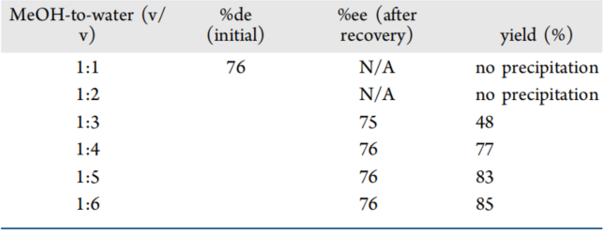
Table 2. S-IBU在25°C下不同比例的甲醇-水混合溶剂的ee%和产率
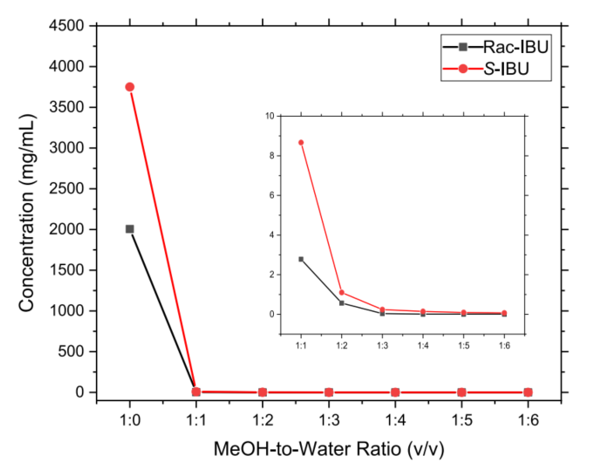
Figure 8. RAC-IBU和S-IBU在25°C下不同比例的甲醇-水混合溶剂的溶解度
(4)反溶剂添加速率与陈化时间:不同陈化时间(2/4/8 h)的研究结果发现陈化时间对产率和ee%没有影响,但结晶度随时间增加而相对增强(图9);不同反溶剂添加速率(3/6/9 mL/min)的研究结果也类似,最慢的添加速率对应获得的晶体结晶度最高(图10)。反溶剂添加速率是调节晶体成核与生长的重要因素,而陈化过程也是让析出的晶体与母液放置的一段时间中,小颗粒逐渐减小至溶解,大颗粒逐渐长大,一定程度上调节晶体的生长进程。二者对于最终产品的颗粒属性、纯度等起到关键作用。
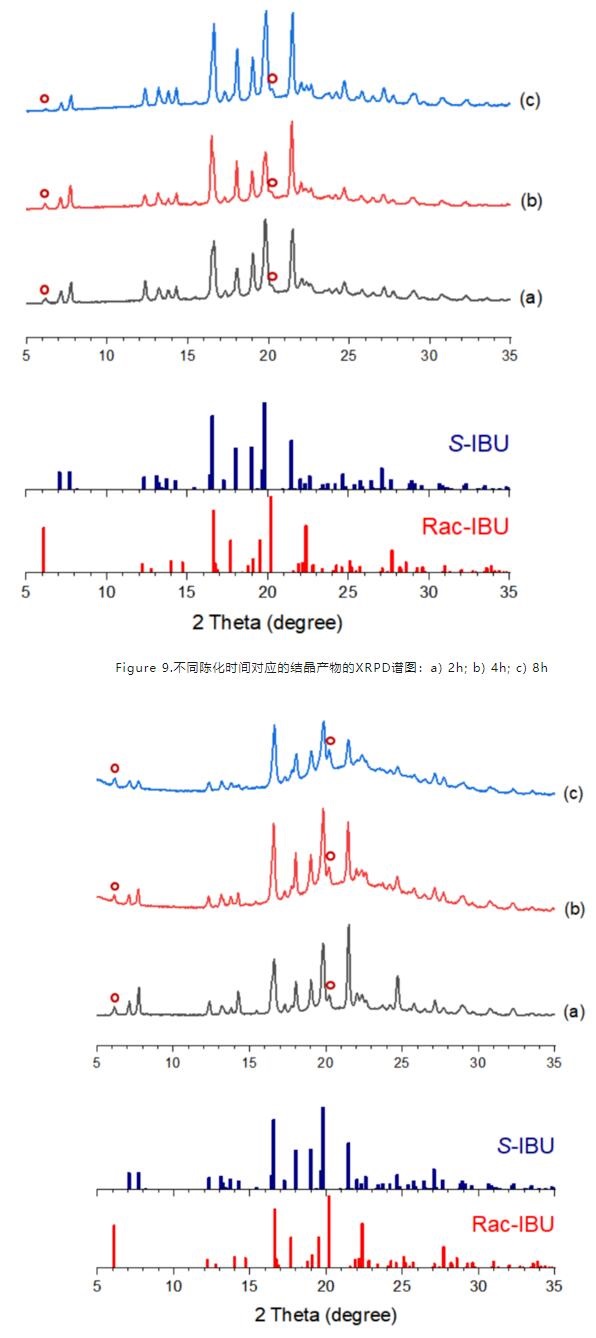
Figure 10.不同反溶剂添加速率对应的结晶产物的XRPD谱图:a) 3mL/min; b) 6mL/min; c) 9mL/min
手性拆分的重要性这边不再赘述,想必“反应停事件”为每一位制药人所熟知并深感惋惜,对于手性药物的非“药用”的异构体,我们需要着重关注是否存在副作用甚至生物毒性,再进一步考虑是否开发稳定高效的拆分工艺来获得纯的异构体手性药物。
非对映体盐结晶拆分作为一种高效拆分的传统手段,相较于其他拆分手段而言,应用面更广泛(外消旋化合物自然界占比最大)、简单高效、成本相对较低、更容易转移至生产放大工艺,展现出更佳的应用优势。
相比于本文献中的单步法操作,每步需分离固体收集相应数据,晶云的手性拆分策略更倾向于开发一个连续稳定的拆分工艺,串联起成盐与冷却结晶两个步骤,以游离态化合物为起始,连续化操作及能得到高de%的非对映体盐。基于对化合物和手性配体性质及二者相互作用的深刻理解,筛选不同的拆分体系,充分考虑上述所提到的各个层面如拆分剂当量比、溶剂体系、温度范围、降温速率等对拆分工艺等的影响,选出最优的工艺体系,并实现工艺放大及转移。
参考文献