


在原料药及制剂研发过程中,药物晶型和其稳定性具有重要影响。同时为了遵循相关法规政策或指导原则,我们需要在研究时,更加关注并深入地探索药物研发中的晶型问题。本系列推文关注申报过程中原料药、制剂中原料药晶型收到的发补问题,并从晶云专业角度进行解读,梳理研发关注内容。
参考指导原则
1)ICH M4 通用技术文档
2)ICH Q6A 《新原料药和制剂的检测以及可接受标准:化学物质》
3)NMPA《化学药品新注册分类申报资料要求》、《化学仿制药晶型研究技术指导原则》
4)EMA 《Guideline on the chemistry of active substances》
5)FDA 《ANDAs: Pharmaceutical Solid Polymorphism》
6)《中国药典, 9015 药品晶型研究及晶型质量控制指导原则》
7)《化学药品创新药Ⅲ期临床试验前会议药学共性问题及相关技术要求》
.....
常见晶型发补问题
01
发补内容
本品存在多晶型,请提供晶型定量研究资料,提供方法学验证资料和多批样品的检测结果,关注引入溶剂化物等混晶的风险。同时请在注册标准中增加晶型鉴别项。
晶云解读
第一阶段:化合物本身存在多晶型现象,即建议在标准中加入晶型鉴别项,需开展定性研究,以回答原料药产品或制剂产品中原料药晶型“是什么”(定性鉴别)的问题;
第二阶段:如存在其他可能影响产品质量的杂质晶型(工艺溶剂选择,引入溶剂化物;制剂工艺条件;贮藏条件等)的可能性,需开展定量研究,可以回答“有没有”(限度)、“有多少”(全定量)杂质晶型的问题。
关注内容:多晶型研究;代表性批次样品表征数据(或单晶数据);定性鉴别(确认杂质晶型种类);定量研究。
最新法规依据:《化学药品创新药Ⅲ期临床试验前会议药学共性问题及相关技术要求》。在早期产品开发时需开展晶型研究,包括晶型筛选、晶型溶解度与溶解速率、结晶工艺开发、晶型稳定性等。需说明选择目标晶型的依据,以及在原料药粉碎、制剂生产及贮藏过程中晶型的稳定情况。原料药经干燥、粉碎、制粒和压片等制剂工艺步骤,在温度和湿度等环境因素的作用下,均可能出现转晶现象,进而影响制剂的溶出行为和(或)生物利用度。因此,通常采用热力学稳定的晶型进行开发,注意避免采用混晶或生产、贮藏过程中发生转晶后形成混晶。
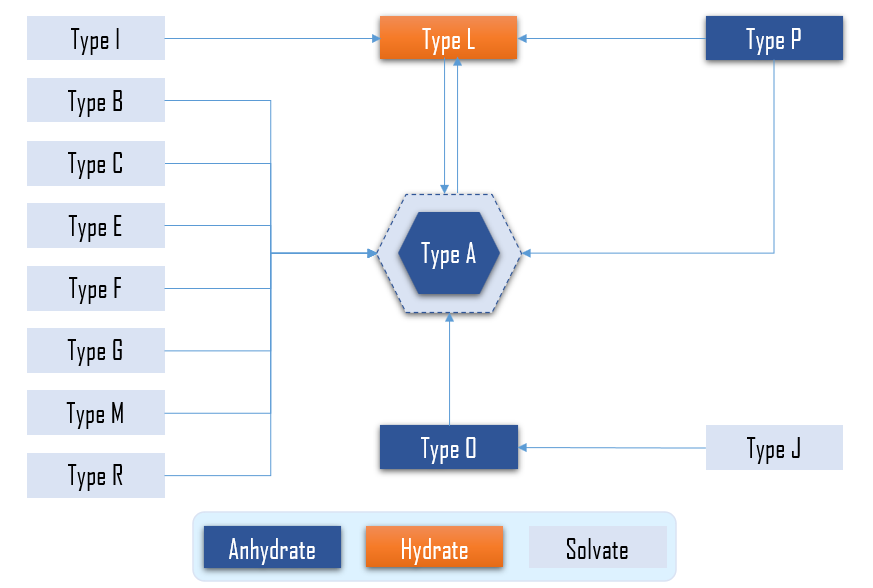
图1 晶型转化关系图
02
发补内容
化合物现有资料不能证明是否为单一晶型,请进一步提供相关研究资料证明。如为混晶,请确认各晶型含量比例,并说明研究所用方法的适用性,并使用该方法证明原料药批间一致性和稳定性。
晶云解读
1)化合物如果为新药,是否研究过多晶型现象,及对应晶型的表征数据图谱(XRPD、TGA、DSC、SXRD等),比对分析是否为单一晶型;如为仿制药,需与专利文献或对照品表征数据比对确认是否为单一晶型;
2)如开发亚稳、ASD样品或制备工艺可能引入转晶条件,则需对可能出现或已出现的杂质晶型做定量(限度/全定量)研究,确认杂质晶型含量。
关注内容:多晶型研究资料;开发工艺;定量方法学研究。
参照法规依据:《中国药典》。1)绝对鉴别法:单晶X射线衍射法,即通过晶胞参数、分子构象等信息拟合XRPD标准图谱;2)相对鉴别法:指纹图谱XRPD作为首选方法,若判断两个晶态样品的晶型物质状态一致时,应平行进行粉末X射线衍射试验,并满足衍射峰数量相同、二者2θ值衍射峰位置误差范围在±0.2°内、相同位置衍射峰的相对峰强度误差在±5%内,衍射峰的强弱顺序应一致;若判断两个无定形态样品的晶型物质状态一致时,应满足弥散衍射峰几何拓扑形状完全一致。
图2 TGA(左)、DSC(右) |
图3 XRPD(左)、SXRD(右) |
03
发补内容
请提供原料药多批粉碎前后的晶型考察数据,以证实批间的一致性,并进一步对本品原料药是否为混晶进行研究和考察,并提供详细的研究资料。
晶云解读
粉碎/微粉化前后多批次的表征数据:XRD、TGA、DSC等,评估是否出现产生无定形结晶度下降,或转晶现象。如果出现转晶,需对可能出现的杂质晶型做定量(限度/全定量)研究。同时关注粒径对于药品性质的影响。
关注内容:晶型稳定性,晶型、粒径检测方法。
总结
晶型研究贯穿药物研发始终,前期的多晶型筛选工作为后续晶型鉴别、定量研究提供转化关系研究、数据图谱对比的支撑。同时仍需结合原料药制备工艺、制剂工艺条件、贮藏条件等综合考虑原料药晶型稳定性,评估指定检查项与内控标准。
晶云具有丰富的项目研发经验,涉及多晶型筛选与评估、晶型转化关系研究、晶型稳定性评估、结晶工艺开发、晶型定性、定量方法学研究等。支持结合实际项目所处阶段与背景信息,进行资料解读,并提供优质的技术方案,支持合作项目的审评对接沟通与审计核查。
原文请点击查阅

