蛋白降解靶向嵌合体(Proteolysis-Targeting Chimera,简称PROTAC),是一种新颖的药物设计策略,它是利用细胞内的泛素-蛋白酶体蛋白降解机制来实现降解蛋白质。PROTAC技术因独特作用机制所带来的突破性优势,尤其是针对不可成药的靶点,受到业界广泛关注,被认为是突破当前小分子药物研发瓶颈最有希望的新技术之一。本文我们将从泛素-蛋白酶体系统、PROTAC技术优势和挑战、PROTAC药物临床进展及常见的PROTAC制剂开发策略四个方面进行介绍。
泛素–蛋白酶体系统介绍
蛋白质更新是维持细胞稳态的重要生理过程,细胞通过控制蛋白质的合成和降解,去除错误折叠的或功能失调的蛋白质,来调控细胞内蛋白质的稳态。泛素–蛋白酶体系统是细胞内蛋白质降解的主要途径,负责细胞内80%以上蛋白质的降解。
泛素–蛋白酶体系统降解蛋白质的机理,简言之是将待降解的蛋白质作为底物打上“泛素”标记,进而被蛋白酶体识别,蛋白酶体如同一台蛋白质粉碎机,将底物切割成碎片,实现精准降解。
泛素(Ubiquitin,简称Ub)是一种存在于大多数真核细胞中的小分子蛋白质(由76个氨基酸组成,分子量大约8.5 kDa),主要功能是标记需要分解掉的蛋白质,使其被蛋白酶体水解。
泛素化是指泛素分子与靶蛋白质连接的过程,是一个由三个酶连续催化的生化过程。主要包括以下三步(详见图1):
泛素在ATP的作用下,与泛素活化酶E1通过硫酯键相连,泛素被活化。
活化后的泛素通过转硫酯化反应转移到泛素结合酶E2上。
泛素连接酶E3将结合到E2的泛素转移到靶蛋白上,使目标蛋白的一个赖氨酸与泛素的羧基端的连接,形成泛素-蛋白复合物。
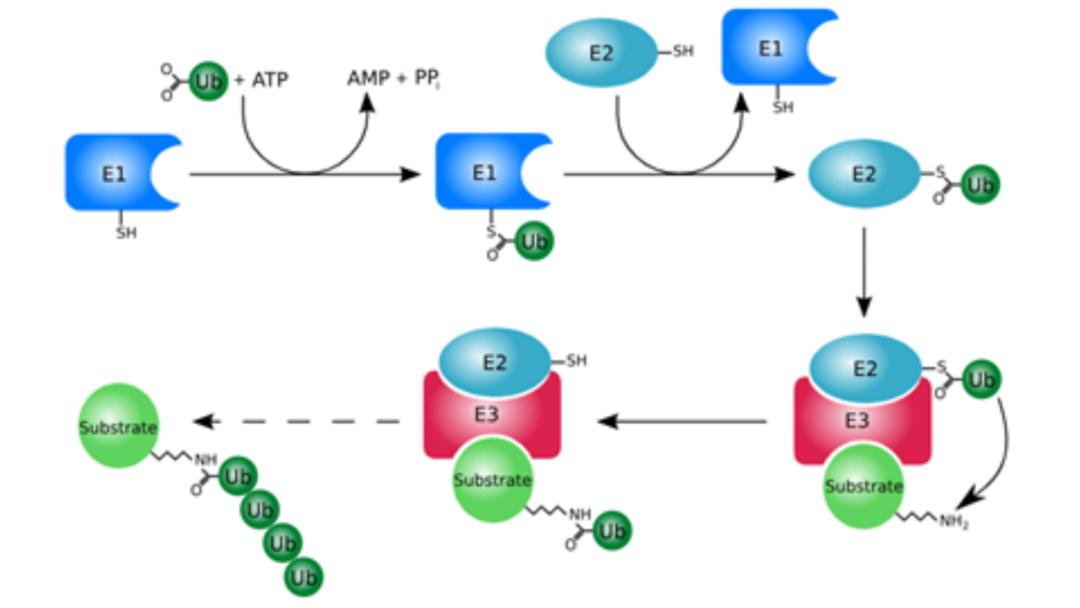
图1 蛋白质泛素化过程
PROTAC技术优势和挑战
PROTAC技术的核心概念为利用人工小分子化合物召集一种特定的泛素连接酶,并通过实现靶蛋白的泛素化来降解蛋白。PROTAC一般由三部分组成:靶蛋白结合配体、E3连接酶结合配体、以及链接两者的Linker,以PROTAC药物ARV-110药物为例,其具体结构和示意图见图2。PROTAC药物通过自身的两个配体分别与靶蛋白和E3连接酶结合,形成靶蛋白-PROTAC-E3连接酶三元复合物,从而启动泛素化过程来降解蛋白,PROTAC可脱离靶蛋白和E3连接酶,释放的PROTAC会继续重复下一个蛋白的降解过程,实现在细胞内循环利用。
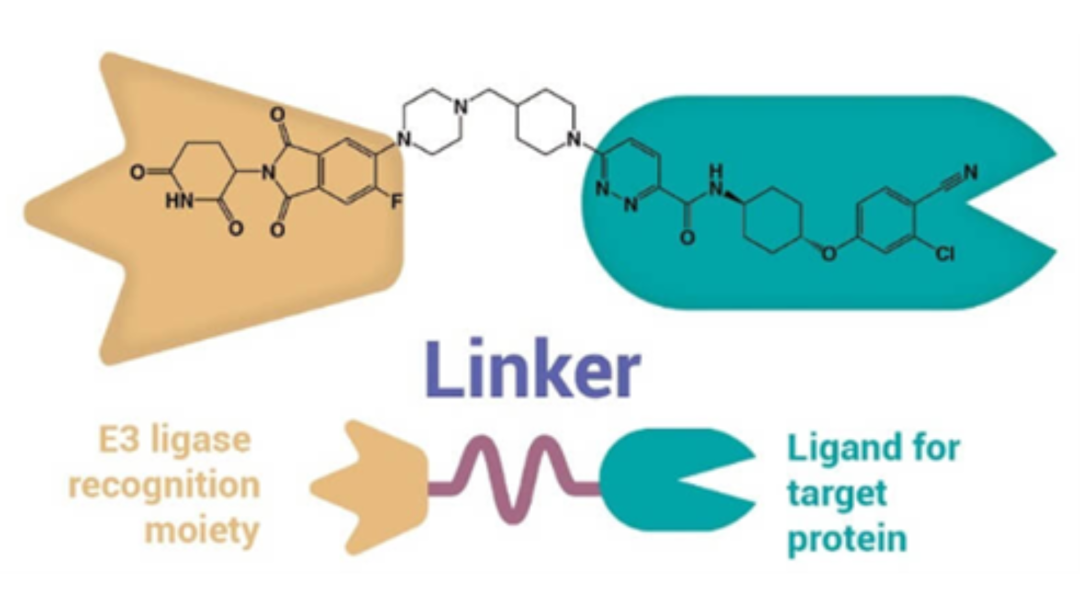
图2 PROTAC分子结构
PROTAC技术优势
第一,具有治疗不可成药靶点潜力
传统小分子药物发挥作用的模式是“占据驱动”,即需要药物与靶蛋白长时间高强度结合,高浓度占据靶点的活性位点阻断下游信号通路,从而抑制靶蛋白功能,实现治疗疾病的作用。而PROTAC作用模式是“事件驱动”,只要有配体能够结合即可发挥作用,因此可以作用于一些小分子无法结合的靶点。
第二,有望克服耐药性问题
由于PROTAC技术通过降解整个蛋白质分子而不仅仅是其激活位点,它可以绕过靶点上的突变或变异,对抗耐药性。
第三,通过催化发挥作用
PROTAC是将靶蛋白与E3泛素连接酶拉近并进行泛素化最终导致靶蛋白的降解,PROTAC可脱离靶蛋白和E3连接酶,实现在细胞内循环利用,每个PROTAC分子可以降解很多个蛋白分子,因此,较低的剂量就可以实现较好的药效。
PROTAC技术挑战
第一,分子设计的挑战
设计和合成有效的PROTAC分子可能是一项复杂的任务。选择合适的连接器、靶向结合域和E3连接酶结合域需要深入了解目标蛋白质和相关生物过程。
第二,口服生物利用度低
PROTAC分子由三部分组成,不可避免地导致相对分子量过大。传统小分子药物分子量一般小于500道尔顿,而PROTAC分子量一般在700以上,违反了Lipinski “类药五规则”,常存在溶解性差、难以穿透细胞膜、口服生物利用度低的问题,因此应在 PROTAC 的研究过程中持续优化理化性质。
第三,缺少系统且合理的成药评价体系
PROTAC分子与传统小分子在体内的药理、代谢机制以及安全性方面都存在较大差异,PROTAC介导的细胞活性受多种因素的调节,需要系统分析 PROTAC的药代动力学(PK)和药效学(PD)性质、脱靶效应和毒副作用,建立针对 PROTAC 合理且有效的成药性评价体系。
PROTAC药物临床进展
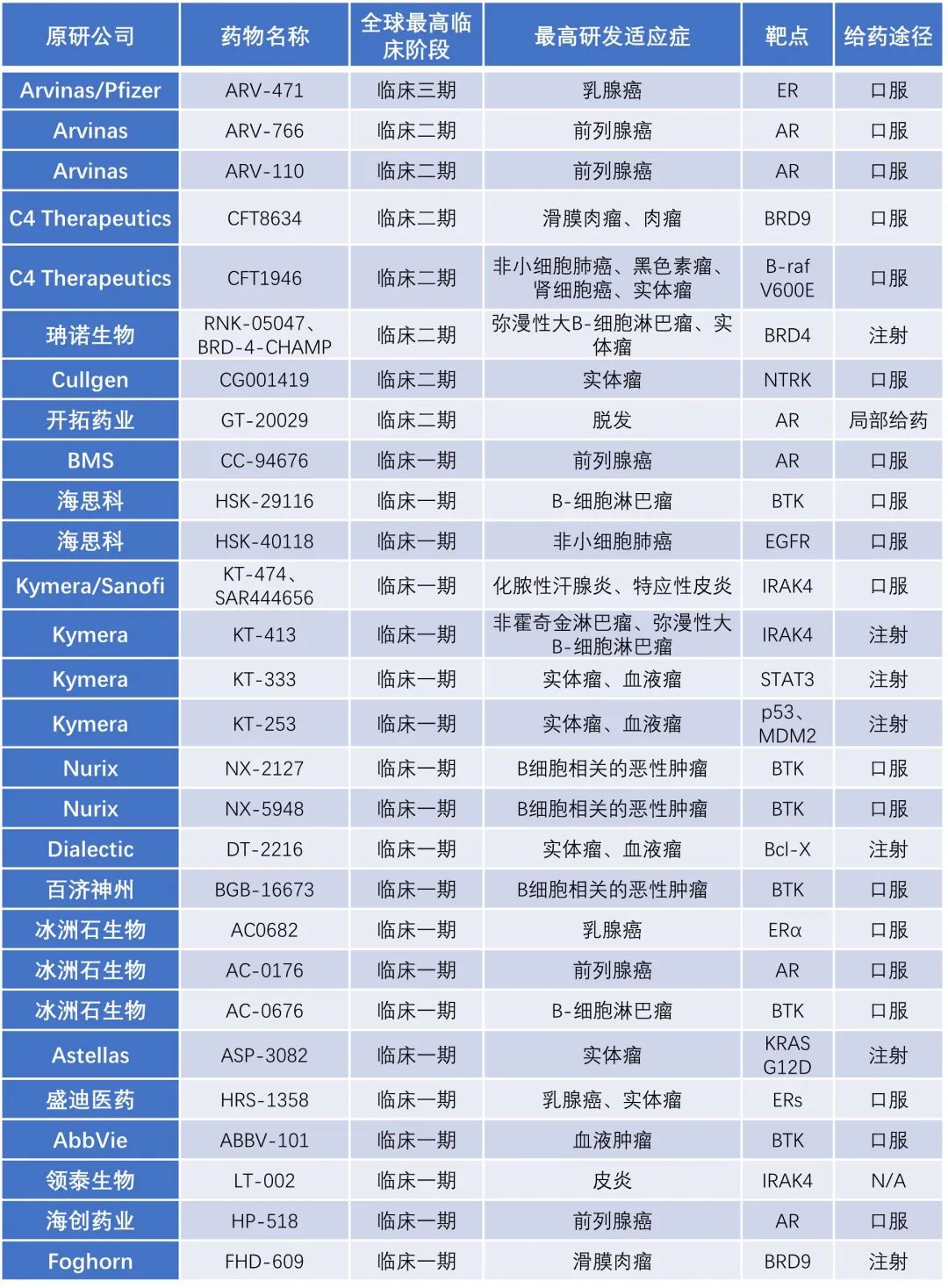
PROTAC的基本概念自2001年被Craig Crews教授团队首次提出,经过二十多年的发展,该技术已经成功从学术界转移到了产业界。2019年,首个PROTAC药物进入临床试验,2020年,针对雌激素受体(ER)和雄激素受体(AR)癌症靶点的PROTAC完成临床上的概念验证,随后,多种药物推进临床阶段。截止2023年6月,全球范围已有28个PROTAC药物进入临床开发阶段(详见表1),其中临床三期1个,临床二期7个,临床一期20个,此外,还有376个药物处于临床前开发阶段。目前PROTAC药物研发覆盖较多的是ER、AR、BTK等成熟药物靶点,适应症主要为前列腺癌、乳腺癌和血液瘤等。
表1 临床在研PROTAC药物(数据来源于药渡)
PROTAC制剂开发策略
口服剂型较注射剂型具有更好的用药便利性,是许多小分子药物开发的首选药用方式。目前临床在研的PROTAC药物以口服剂型为主,占比68%(19/28)。然而,正如前文所述,PROTAC为三组分药物,分子量较大,违反了Lipinski “类药五规则”,口服剂型的开发可能需要解决溶解度低、渗透性低而导致生物利用度低的问题。为了解决上述问题,一方面,需要通过合理的分子结构设计,从源头上实现药物溶解度和渗透性的提高;另一方面,可通过制剂的手段,如开发无定形固体分散体,添加增溶剂等。无定形固态分散体是提高药物生物利用度的重要手段,其中喷雾干燥和热熔挤出是制备无定形的重要的手段,被广泛应用在制药领域。
ARV110制剂策略分析
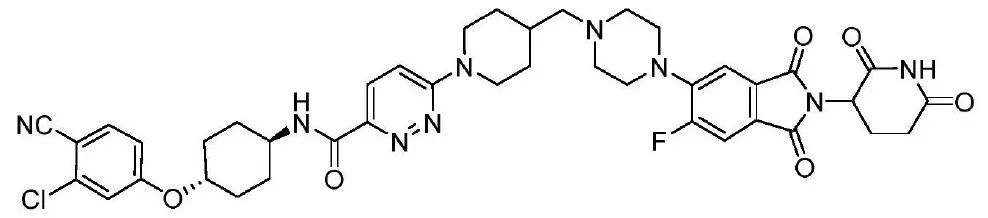
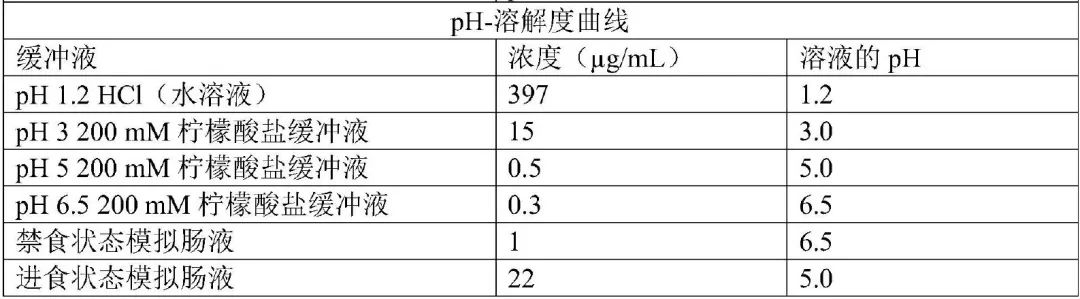
ARV110 是Arvinas开发的一款治疗前列腺癌的PROTAC药物,结构式如图3所示。该化合物是典型的BCS IV类分子(低溶解性、低渗透性)。其pH-溶解度曲线结果见表2,在禁食状态模拟肠液(FaSSIF)里溶解度仅为1 μg/mL。为了开发该化合物,Arvinas将喷雾干燥技术和传统的制剂技术结合,开发出溶出迅速、稳定性良好的片剂,并成功推进临床试验。
图3 PROTAC分子结构
表2 ARV110(结晶形式)pH-溶解度曲线
ARV110的无定形溶解度显著高于晶型溶解度,晶型与无定形动态溶解度的对比情况见图4。因此,Arvinas采用喷雾干燥技术将API转变为无定形形态。不同于一般的含有药物、聚合物的无定形固体分散体,Arvinas研发人员发现纯喷雾干燥无定形药物仍然具有良好的物理化学性质,纯无定形形态药物玻璃化转变温度(Tg)为146 ℃,高于含聚合物载体的无定形固体分散体的Tg,较高的玻璃化转变温度,有利于药物的物理和化学稳定性。且基于大鼠、狗等动物模型PK的结果,纯无定形药物的体内药动学行为不劣于无定形固体分散体,因此,Arvinas处方开发中直接采用了纯无定形药物。不过,笔者认为,如果经过更加系统的无定形固体分散体的筛选和开发,还是很有可能能够寻找到一个更优的无定形固体分散体配方,有可能比纯无定形药物展现出更好的溶出和溶解度的提高,且有足够的玻璃化转变温度,能够有效避免无定形的重结晶风险,具备较好的物理和化学稳定性。从图4的动态溶解度曲线来看,纯无定形药物的溶解度在切换到pH 6.5 模拟肠液(SIF)后,最初在pH 2.0 HCl溶液中形成的更高的浓度持续下降直到在50分钟时达到了一个稳态。如果采用合适的无定形固体分散体,有可能通过合适的高分子或表面活性剂起到较好的过饱和度维持作用,从而在体内展现出更优的生物利用度。
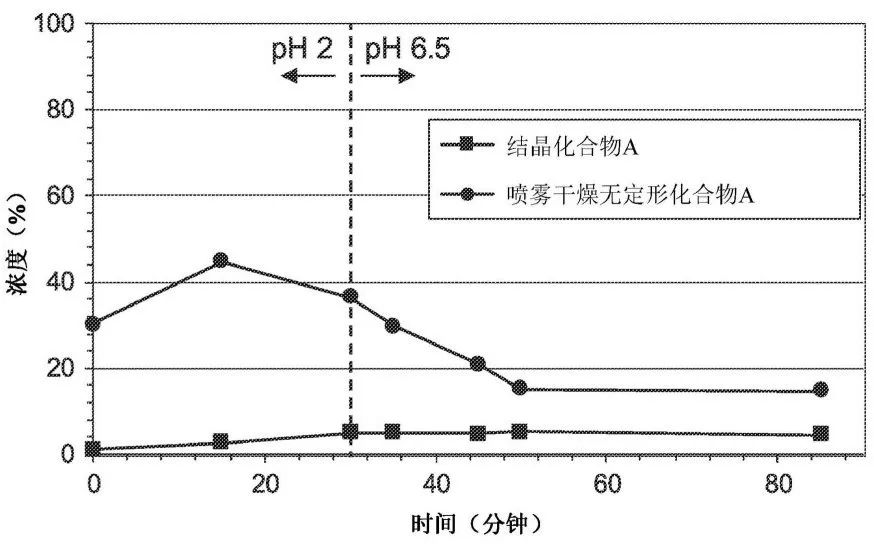
图4 晶型和无定形形态化合物A动态溶解度对比
(pH 2为HCl溶液,pH 6.5为模拟肠液)
ARV110的临床给药剂型采用应用最广泛的片剂。除主药成分外,处方中加入了填充剂、崩解剂、助流剂和润滑剂。开发的处方如表3所示,其溶出快速、完全(图5所示),且工艺可开发性、其他产品性能等均满足要求,最终成功用于临床剂量爬坡试验。
表3 临床剂量爬坡试验-制剂处方
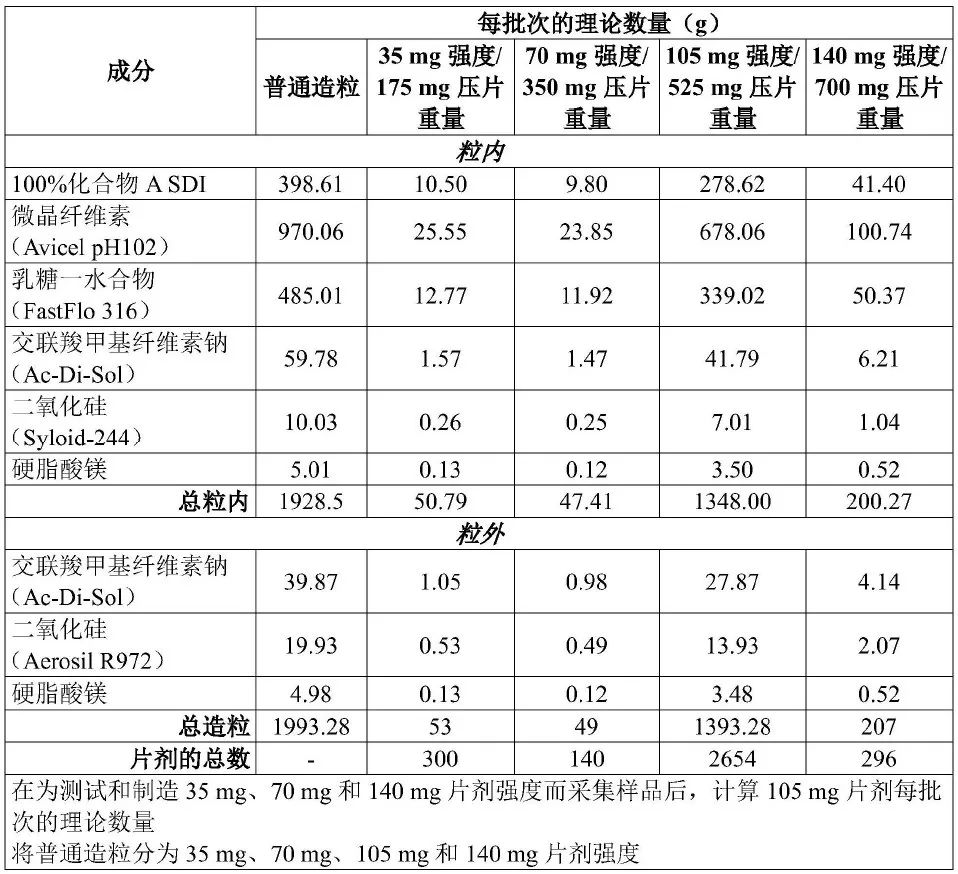
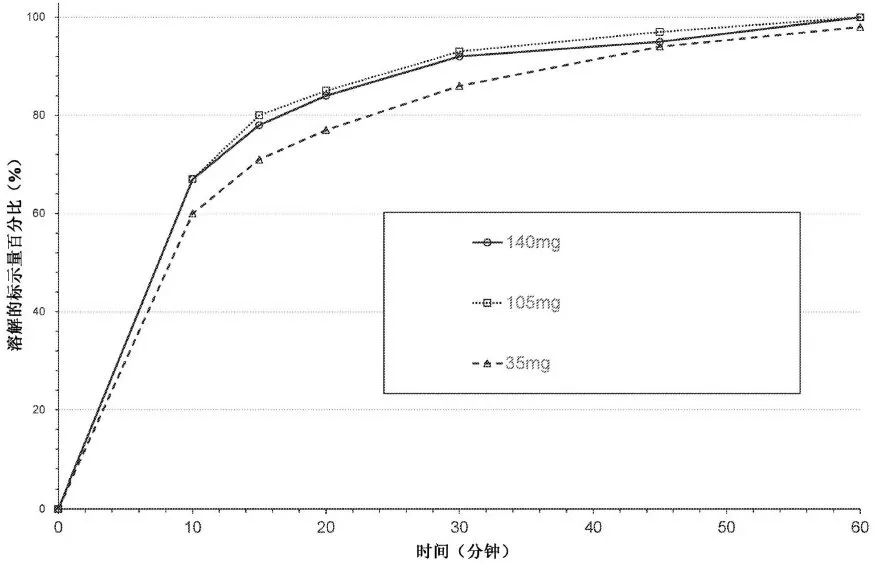
图5 35 mg、105 mg、140 mg演示批溶出曲线对比
结语
从PROTAC概念的提出到PROTAC药物进入临床评估已经走过20余年,作为一种新兴的技术,PROTAC因有望解决不可成药靶点和耐药性问题,引起了学术界以及制药界的广泛关注。与此同时,基于该技术的药物开发也面临诸多挑战。PROTAC相对分子量较大,部分药物存在难结晶、难溶、难渗问题,并且药物通常存在口服生物利用度低的问题,因此,应在PROTAC的研究过程中持续优化分子设计、药物固态理化性质以及选择合适的制剂开发策略,以提高药物的生物利用度。
晶云药物是一家专注于小分子药物晶型和制剂开发和生产的CRO/CDMO公司,晶云药物CRO事业部目前已完成超过10个PROTAC药物的晶型筛选和研究工作,帮助客户选择合适的API的固体形态进行开发。至今为止,我们成功筛选得到PROTAC药物晶型的比例超过90%,且根据客户的需求,我们为许多PROTAC项目展开了临床前处方开发,包括无定形固体分散体制剂,纳米晶体制剂等,以支持PROTAC口服或者注射给药。晶云药物CDMO事业部(晶云星空)专注于口服制剂领域,密切关注PROTAC药物的最新进展。大部分PROTAC分子难溶难渗,其成药性方面存在较大的挑战,但挑战与机遇并存,晶云星空一直和PROTAC新药公司一起,积极探索利用无定形固体分散体制剂技术提高PROTAC药物口服生物利用度的新配方和新手段。晶云药物秉承首次正确的“晶型+制剂”的服务理念,可为您的PROTAC药物提供首次正确三步走解决方案,从第一步的可开发性评价,到第二步的晶型筛选和选择、以及临床前处方研究,直到第三步的制剂开发和生产、以及临床供应服务,从而帮助您将PROTAC药物迅速推进到临床及商业化。
参考资料
[1] Wikipedia
[2] Miklós Békés, et al. PROTAC targeted protein degraders: the past is prologue[J]. Nature RevIews Drug Discovery, 2022, 21(3): 181-200.
[3] Ke Li, et al. PROTACs: past, present and future[J]. Chem. Soc. Rev., 2022, 51: 5214-5236.
[4] Florian Pöstges, et al. Solubility Enhanced Formulation Approaches to Overcome Oral Delivery Obstacles of PROTACs. Pharmaceutics 2023, 15, 156-169.
[5] 李炳坤等. 基于蛋白降解靶向嵌合体(PROTAC)的药物研发新模式[J]. 军事医学, 2023, 47(1): 1-12.
[6] 专利CN115996918A