

“火球落在地上,蓝色的火焰逐渐熄灭,原来是一只奇形怪状的小瓢虫,全身都像是红色的透明水晶,翅膀更是晶莹剔透,可以通过透明的甲壳,依稀看到里面的半透明内脏,其中似乎隐隐有火焰在流动,看上去说不出的神秘诡异。” From 《鬼吹灯之精绝古城》
这是鬼吹灯中描述怪物之一—火瓢虫的一幕。胡八一等一行人去昆仑山执行任务碰到这种虫子的袭击,只要被其触碰即刻全身燃烧起蓝色火焰,顷刻间整个人会被烧成灰烬……
“生活”磷 &“艺术”磷
PHOSPHORUS IN LIFE AND AIRTIST
其实,火瓢虫内部的蓝色火焰是尸体内的“磷”发出的光,磷造成了人体的自燃(当然文学作品中应用了夸张的手法)。
爱看灵异惊悚类小说的小伙伴们对鬼火不陌生吧。实际上,这东西小编小时候还真就在傍晚乡间的小路上碰到过,甚至还会跟着我一起走动,着实给我吓了好一阵子(小编胆小,属于是又菜又爱玩选手,恐怖小说忠实爱好者了,所以…)。但知识给予我勇气,现在我知道了:这种现象也是由于“磷”自燃产生的。
这种易燃的“脾性 ”必然会造成一些安全事故,近些年发生过好多起白磷自燃引发的火灾,虽然未能造成大规模人员伤亡,但灾后的大量“酸雾”对环境不友好,还弄得人心惶惶,总归是让我们忌惮的存在。

火柴怎么擦一擦就燃烧起来了?这同样也是火柴盒两旁“擦料”中的成分红磷所致。这样看来,磷确实是渗透了我们的生活和艺术作品,就算可能没见过“本人真面目”,初中化学的元素周期表怕是每个人都背了不下一遍又一遍吧。那么今天,小编为大家揭开磷的真实面纱,看看这位脾性较为“火爆”的东西究竟是啥样儿。

磷的分类
磷氏大家族里其实有好几个成员:白磷、红磷、黑磷、它们都是磷的同素异形体,拥有不同的分子结构,从而晶体构型也不同,最终表现为物理化学性质差异。接下来,咱们依次来介绍这些成员~

同素异形体:单一化学元素因排列方式不同形成具有不同理化性质的单质,例如氧气和臭氧,金刚石和石墨。
多晶型现象:化学组成相同的物质,在不同的物理化学条件下,能结晶成两种或多种不同结构的晶体的现象。
白磷
无论在溶液状态还是气体状态下,白磷均以P4的分子形式存在,构成分子晶体。纯的白磷是无色透明的晶体,但遇光照后表面会发生弱氧化反应生成成分复杂的磷氧化物,变成黄色,所以又叫黄磷。

磷元素的发现最早追溯于欧洲中世纪的炼金术起。那时,许多炼金术家在拼命寻找一种可以点石成金的“哲人石”。于是出来了一个叫“布朗特-汉宁”的商人,他收集了50木桶人尿,与沙子等物质混合一起加强热,黄金没制成,却拿到了一个白蜡一样的东西,能在暗处发出蓝绿色冷光,于是他给这个新物质命名为“磷”(它的拉丁文名称Phosphorum即为冷光的意思)。

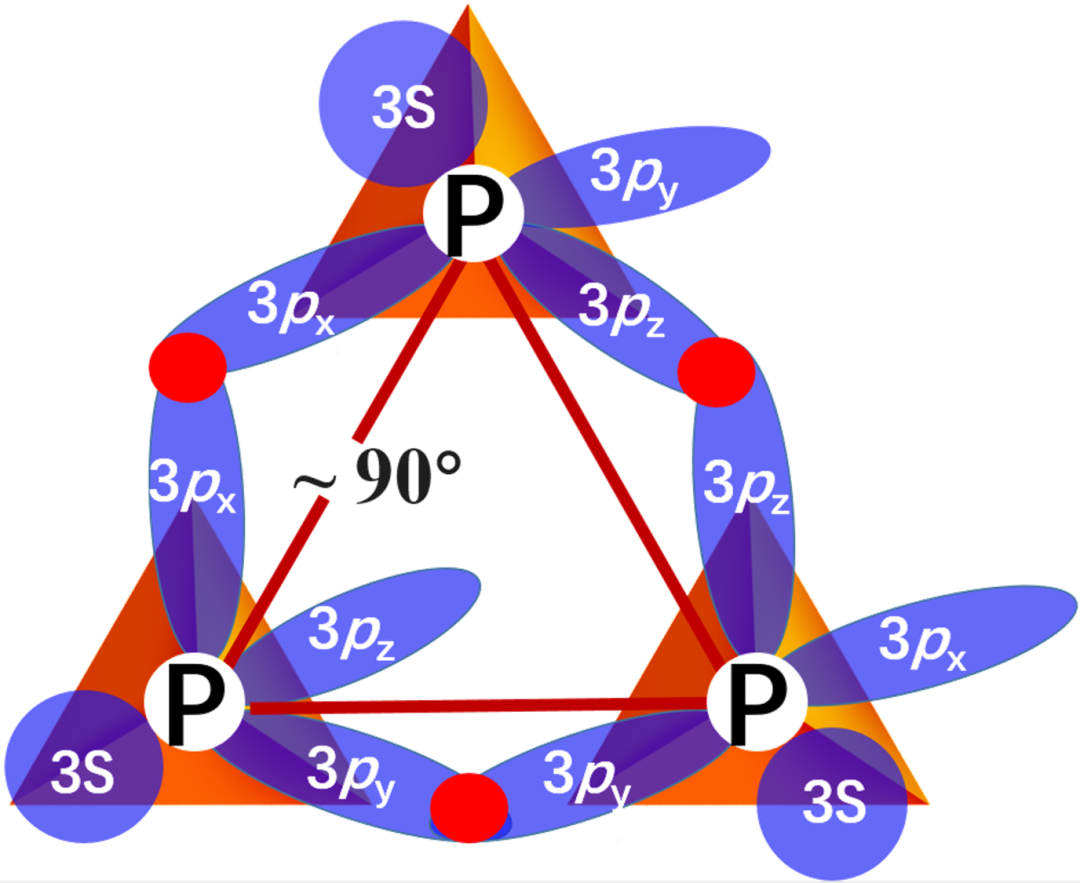
白磷是磷氏家族中最活泼、脾气也最火爆的小弟,这是因为其分子结构中的四个磷原子构成了一个正四面体,理论键角为60°,但实际上其分子中的P-P键98%是P原子间分别用3p轨道“肩靠肩”重叠形成的共价键,而p轨道成键的键角一般是90°,为了努力向60°靠近,P-P键受到了很大应力而弯曲,非常不稳定,因而具有很高的化学活性,着火点只有40 ℃,在空间中就会自燃生成大量浓烟。也是因为这种属性,没法儿在室温下用X射线衍射去探测它的实际晶体结构。
【 白磷的多态性 】
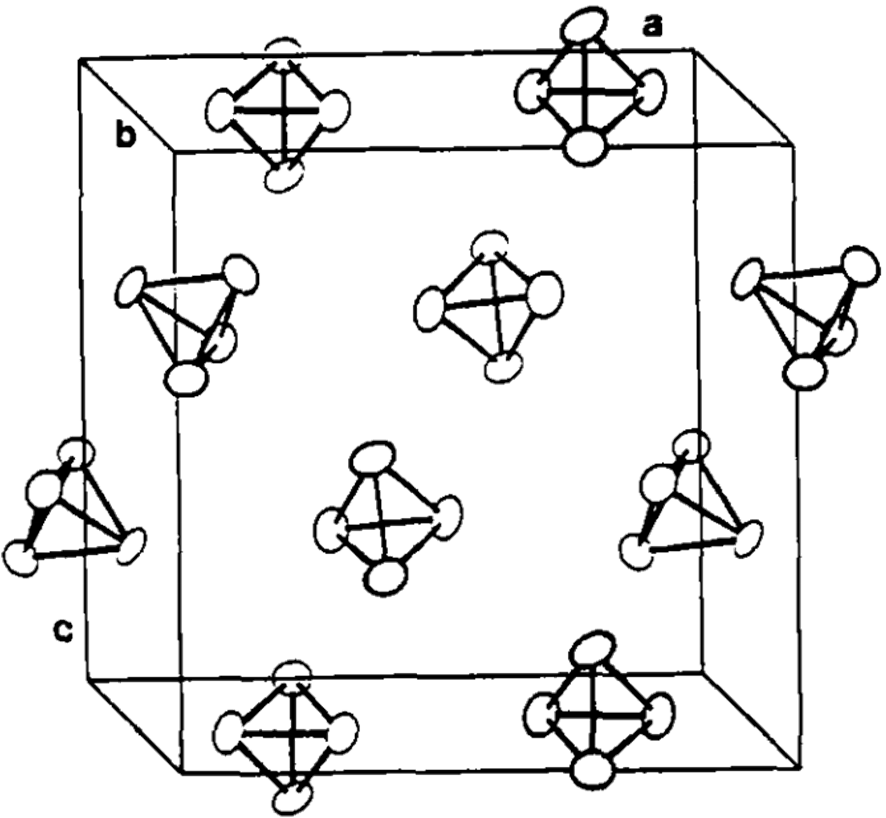
已知白磷在不同温度和压力下以三种晶型存在:α-型、β-型和γ-型。三种晶型的互变与温度和压力相关。在室温下,常以α-型形式存在,它和金属锰单质的α晶型结构类似,属于立方晶系,一个晶胞中含58个P4四面体,其中,每个P4分子围绕其重心动态旋转,如下图所示。显微镜观察下为针状。

(图为金属锰α晶型结构,P4分子替代每一个金属锰原子即构成白磷的α-型结构。)
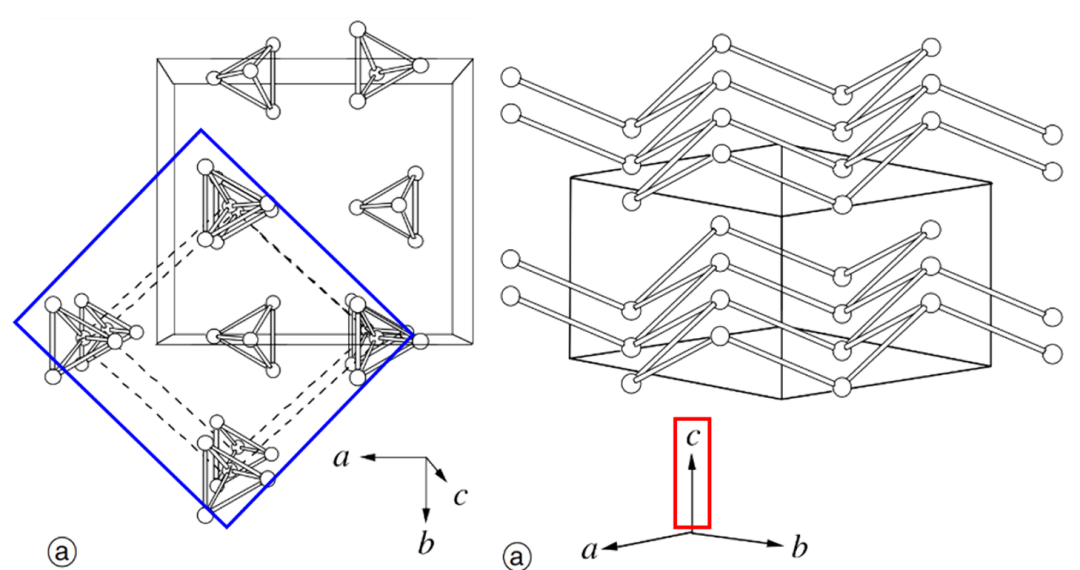
Bridgman发现α-型在温度低于-77℃的环境压力下或压力低于10kbar的室温条件下会转为β-型,这是一种可逆的转变,在适当的条件下又能回到普通型(α-型白磷)。在β型中,P4分子排列是有序的,但对称性降低。同α-型一样,它的结构也与金属元素的结构密切相关—与金属钚γ晶型结构类似,属于斜方晶系,如下图所示:
(图为β-晶型白磷的结构,即白磷的P4分子替代了每一个金属钚原子)
Spiess等人发现了白磷另一种晶型的存在—γ-型。它是在α-型被淬灭到-165 ℃并在该温度下保持数小时内形成,这同样也是一种可逆相变,当回温至-115 ℃时,γ-型即转化为β-型。但再次降温无法重新得到γ-型。单元晶胞属于单斜晶系,P4分子的重心形成了扭曲的六边形网,单个六边形具有椅式构象,六边形网在c-方向上转移至堆叠,因此形成了一个扭曲的体心立方,如下图所示:
(图为γ-型白磷的晶体结构)
白磷小弟的脾性就和他的“身份”一样多变,存放在冷水中完全隔绝空气时它是温柔冷静的,但一旦触碰到空气就会立马火爆起来。所以在战争时期,它被广泛应用于军事来制造烟雾弹、燃烧弹。而且,白磷有剧毒,极易被人体透皮吸收,中毒剂量为15 mg,致死量为50 mg,可千万别随便碰它。万一不小心碰到,要立即用大量水冲洗,然后用硫酸铜或硝酸银溶液涂抹;若不小心误服,则需尽快就医。现工业上常用其来制备高纯度磷酸、红磷、杀鼠剂和有机磷酸酯等。
红磷
二哥红磷和白磷小弟比起来,脾气会温和很多,一般要在240 ℃才燃烧,常温下稳定也无毒。1845年,奥地利化学家施勒特尔发现了红磷,确定它与白磷是同素异形体 。但和白磷的简单结构相比,红磷的结构更为复杂,且至今尚未有明确结论,因此它还未有具体分子式,一般以P作为其化学式。
【红磷的多态性 】
和它小弟一样,红磷也并非只有一种,它的结构被认为是不同结构单元构成的线性高聚物网络。1947年,Roth等人报道了红磷至少存在五种不同同素异形体I~V。I型为市售的无定形红磷,并通过进一步退火,形成II、III、IV和V四个晶型,它们的结构如下图所示:
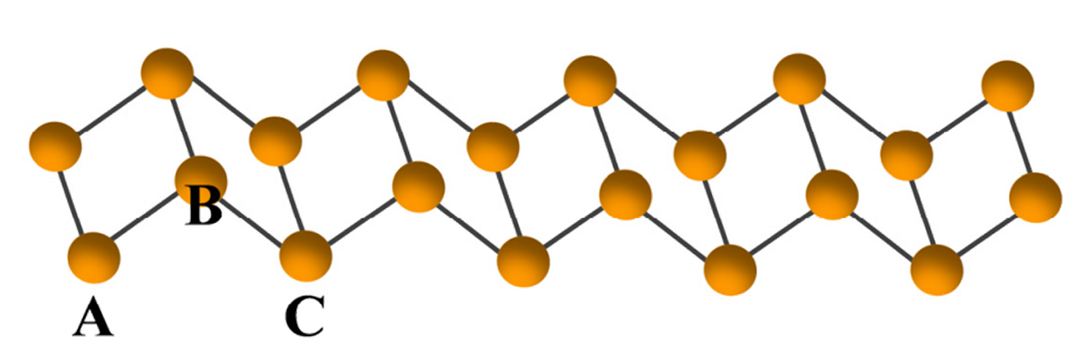
(I-型,无定形红磷,链状梯形结构,1990年Häser提出)
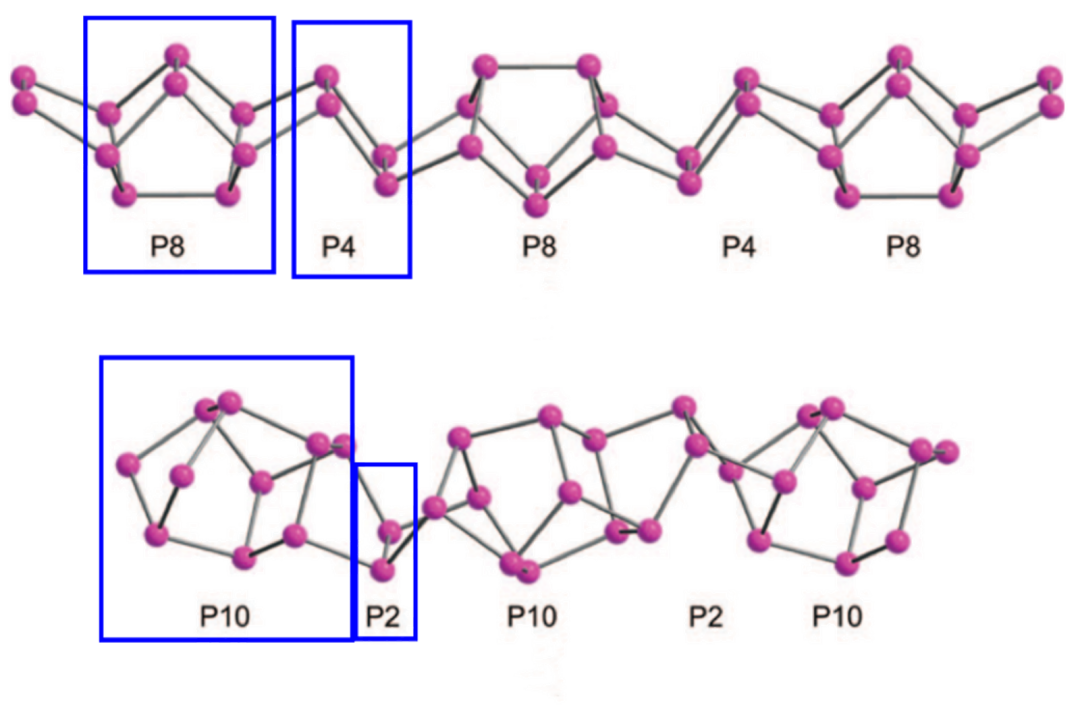
(II-型,-P8-P4-或-P10-P2循环构成的螺旋链结构,与近期发现的多晶磷纳米棒结构形式相似)
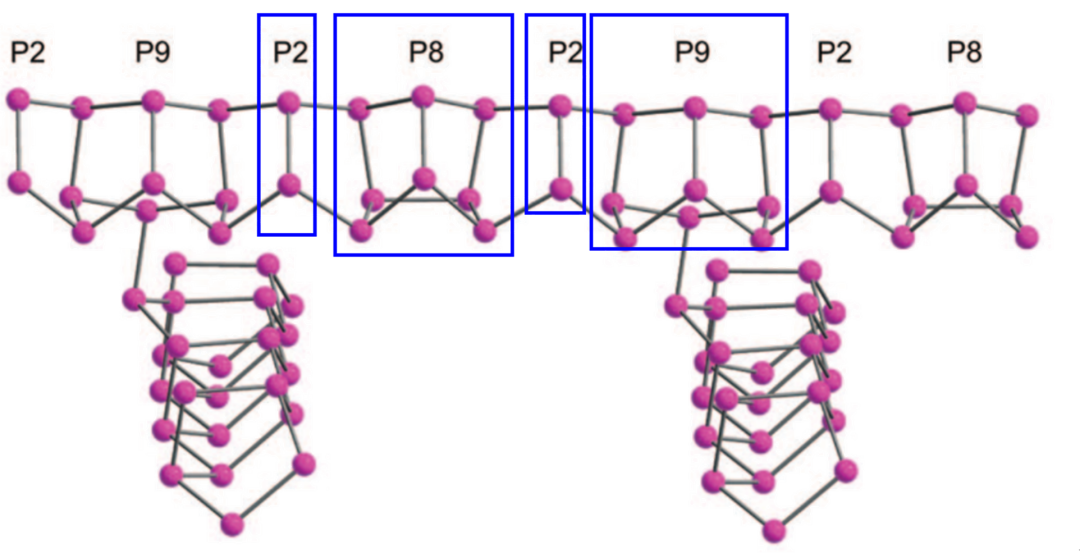
(IV-型,又称紫磷,由-P2-P8-P2-P9-循环构成的管状结构,1865年Hittorf首次发现)
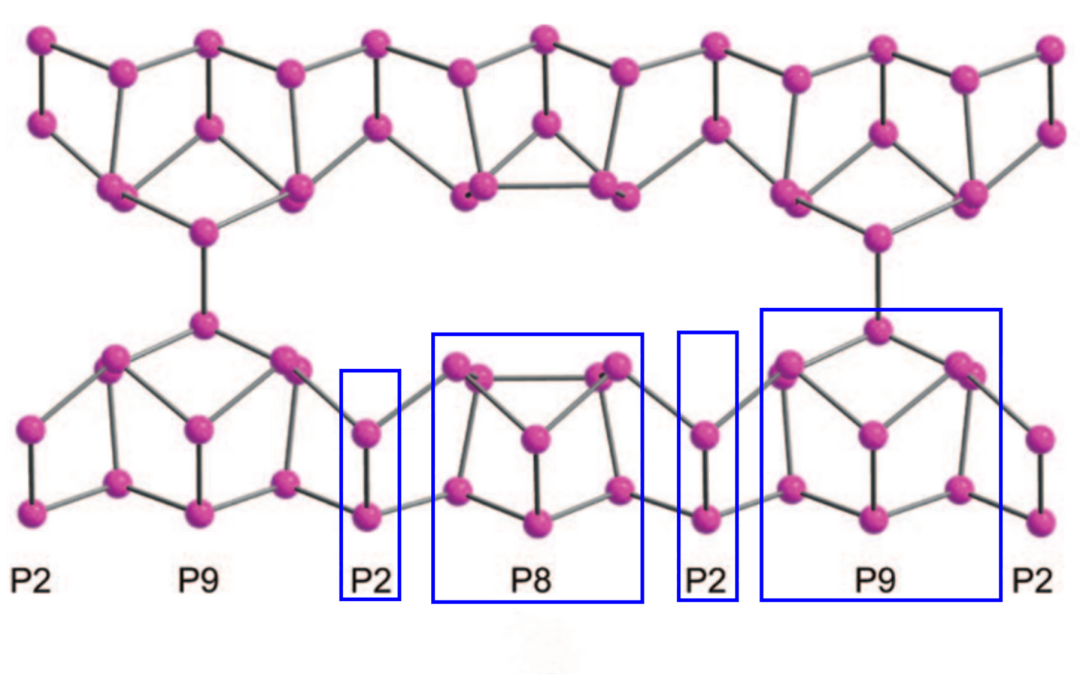
(V-型,又称纤维磷,由-P2-P8-P2-P9-循环构成的层状结构,最近Ruck等人发现)
Note:III-型晶体结构尚未能确认,因其稳定的温度范围较小,难以控制。
早期的火柴盒两侧擦料本是白磷做的,但其易自燃不安全,红磷的发现实现完美替代并一直沿用至今。它还可用于生产阻燃剂、有机磷农药等。此外,红磷在光电领域中也具有良好的应用前景:通过高能超声技术合成的非晶红磷薄膜可以作为锂离子电池阳极,理论比容量达到2137 mA·h·g-1,添加还原的氧化石墨烯材料后,即使经过200次循环,电池的比容量仍能达到706 mA·h·g-1(而一般石墨负极的理论比容量才372 mA·h·g-1);晶态红磷(如纤维磷、纳米磷、紫磷等)也可作为电极材料,或为性能良好的半导体材料。通过金属铋催化、元素辅助的化学蒸汽传递反应、温和的溶剂热合成法等实现无定形红磷向晶态红磷的转变。
当白磷被紫外线加热、照射或者在隔绝空气下加热至273 ℃会转化为红磷,而红磷在隔绝空气加热至416 ℃升华凝结转化为白磷。
黑磷
黑磷是这个家中最稳重的大哥,脾气最好最冷静,它是具有金属光泽的黑色晶体,能导电,着火点为490 ℃,通常难以发生化学反应。1914年美国物理学家Bridgman首次在高压高温条件下用白磷合成了黑磷这种同素异构体。同红磷一样,它有着极为复杂的空间结构,因而也只能以P作为其化学式。
【黑磷的晶态结构】
黑磷晶体由双层褶皱形成,属于正交晶系,其中每一层都由一条相互连接的磷原子形成的平行锯齿链组成。它有着类似石墨的片状结构(波形层状结构),结构中的每个磷原子在3p轨道上有5个价电子,这些电子通过形成共价键而饱和,从而产生sp3杂化。其中,相邻磷原子的两个共价键在同一平面上,第三个键连接上/下面的磷原子,从而将双层的上/下部分连在一起,如下图所示:
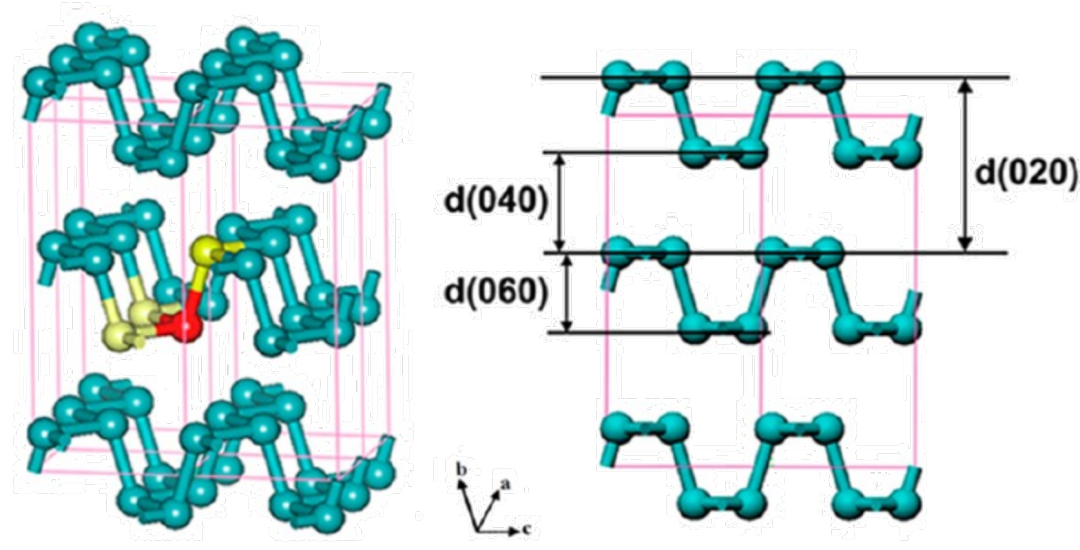
(图为黑磷结构)
因为黑磷结构和石墨的片层结构相似,所以外观、性能上很像石墨,比如能导电,可用来制作半导体和集成电路的电子材料(如场效应晶体管、传感器)等;作为用于水分裂的新材料、光伏太阳能电池和光电探测器等。与红磷类似,它还可以直接应用于锂离子电池中的阳极材料,理论比容量达到2596 mA·h·g-1,用于提高电池能量密度。但由于黑磷的空气稳定性是一个长久未被解决的问题(暴露在环境中会降解,表面被氧化为磷氧化物,进一步反应形成磷酸),所以越来越多的研究是将黑磷与各种碳同素异构体联合使用,制得更稳定的纳米复合材料。
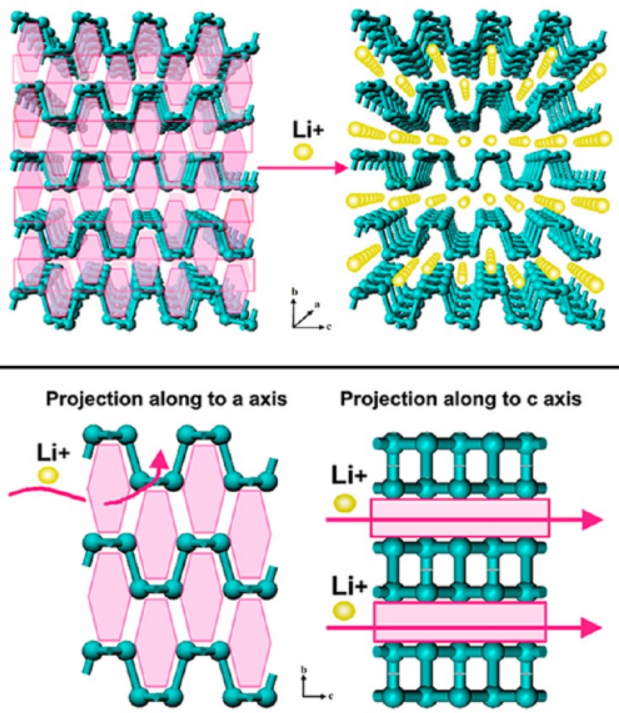
(图为黑磷在锂离子电池中的应用)
目前,可以通过多种方法实现白磷/红磷向黑磷的转变,甚至可通过控制温度、压力和变温速率等因素实现理想晶体的形成。另外,机械法、非金属催化也可实现非高温高压下黑磷的的形成。
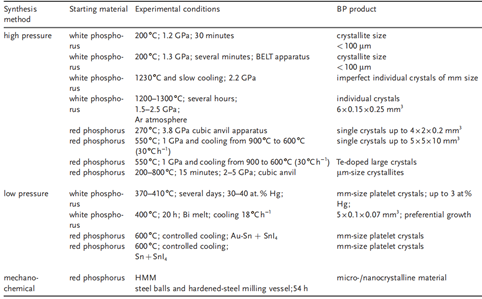
(标位以白磷/红磷为起始合成黑磷的方法汇总)
总结
SUMMARY
看到这里,每一位磷氏成员的“相貌,脾性”想必大家都有个基本概念了。用科学打败未知的恐惧,相信当你再独自走在夜晚的乡间小路上,正碰见这泛着幽幽蓝绿光的磷火,不会再浮想联翩以致加快脚步~
虽然,家族里确有脾气不好的“危险人物”,但每一位磷氏成员都可以合适条件下为我们所用,以他们独特的方式给我们的科技生活的带来更多便利。
参考文献
[1] Corbridge D. The structural chemistry of phosphorus. J. Struct. Chem. 1974.
[2] Schnering H. Homoatomic Bonding of Main Group Elements. Angew. Chem. Int. Ed. 1981, 20, 33.
[3] Simon A, Borrmann H, Craubner H, et al. Crystal Structure of Ordered White Phosphorus(β-P). Phosphorus Sulfur Silicon Relat. Elem. 1987, 30, 507.
[4] Okudera H, Dinnebier R E, Simon A. The crystal structure of γ-P4, a low temperature modification of white phosphorus[J]. Z. Kristallogr. 2005, 220, 259.
[5] Natta G, Passerini L. The crystal structure of white phosphorus. Nature, 1930, 125, 707.
[6] Simon A, Borrmann H, Horakh J. On the Polymorphism of White Phosphorus. Chem. Ber. 1997, 130, 1235.
[7] Scott D J, Cammarata J, Schimpf M, et al. Synthesis of monophosphines directly from white phosphorus. Nat. Chem. 2021, 13, 458.
[8] Du L, Zhao Y, Wu L, et al. Giant anisotropic photonics in the 1D van der Waals semiconductor fibrous red phosphorus. Nat. Comm. 2021, 12, 1.
[9] Cartz L, Srinivasa S R, Riedner R J, et al. Effect of pressure on bonding in black phosphorus. J. Phys. Chem. Lett. 1979, 71, 1718.
[10] Sun L Q, Li M J, Sun K, et al. Electrochemical activity of black phosphorus as an anode material for lithium-ion batteries. J. Phys. Chem. C, 2012, 116, 14772.
[11] Gusmao R, Sofer Z, Pumera M. Black phosphorus rediscovered: from bulk material to monolayers. Angew. Chem. Int. Ed. 2017, 56, 8052.
[12] Zhang S, Qian H, Liu Z, et al. Towards unveiling the exact molecular structure of amorphous red phosphorus by single‐molecule studies. Angew. Chem. 2019, 131, 1673.
[13] Roth W L, DeWitt T W, Smith A J. Polymorphism of red phosphorus. J. Am. Chem. Soc. 1947, 69, 2881.
[14] Ruck M, Hoppe D, Wahl B, et al. Fibrous red phosphorus. Angew. Chem. Int. Ed. 2005, 44, 7616.
[15] Scheer M, Balázs G, Seitz A. P4 Activation by Main Group Elements and Compounds. Chem. Rev. 2010, 110, 4236.
[16] Chien N V, Shin H, Song J Y. Sn-assisted solid state crystallization of red phosphorus to black phosphorus. Scr. Mater. 2020, 177, 128.
[17] 萧功伟. 金属间化合物晶体结构的研究——Ⅳ. σ 相及 α-Mn 结构相晶体结构的新解释[J]. 江西科学, 1990, 8,1.
[18] Bridgman P W. Two new modifications of phosphorus. J. Am. Chem. Soc. 1914, 36, 1344.